Nicht angemeldeter Benutzer - Bearbeiten von Seiten ist nur als angemeldeter Benutzer möglich.
Silber: Unterschied zwischen den Versionen
| [unmarkierte Version] | [gesichtete Version] |
(Version von J. Stiller wiederhergestellt. Die vorige Version war notwendig, um eine Referenz des Originalartikels zum Vergleichen zu haben.) |
K (Interwikilinks anpassen) |
||
| (12 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | '''Silber''' ist ein [[chemisches Element]] mit dem [[Elementsymbol]] '''Ag''' und der [[Ordnungszahl]] 47. Es zählt zu den [[Übergangsmetalle]]n. Im [[Periodensystem]] steht es in der [[Periode-5-Element|5. Periode]] und der 1. Nebengruppe (Gruppe 11) oder Kupfergruppe. Das Elementsymbol Ag leitet sich vom [[latein]]ischen Wort '''''a'''r'''g'''entum'' für „Silber“ ab. Silber gehört zu den [[Edelmetalle]]n. | + | '''Silber''' ist ein [[chemisches Element]] mit dem [[Wikipedia:Elementsymbol|Elementsymbol]] '''Ag''' und der [[Wikipedia:Ordnungszahl|Ordnungszahl]] 47. Es zählt zu den [[Wikipedia:Übergangsmetalle|Übergangsmetalle]]n. Im [[Periodensystem]] steht es in der [[Wikipedia:Periode-5-Element|5. Periode]] und der 1. Nebengruppe (Gruppe 11) oder Kupfergruppe. Das Elementsymbol Ag leitet sich vom [[latein]]ischen Wort '''''a'''r'''g'''entum'' für „Silber“ ab. Silber gehört zu den [[Wikipedia:Edelmetalle|Edelmetalle]]n. |
| − | Es ist ein weiches, gut verformbares ([[Duktilität|duktiles]]) [[Schwermetalle|Schwermetall]] mit der höchsten [[Elektrische Leitfähigkeit|elektrischen Leitfähigkeit]] aller Elemente im unmodifizierten Zustand (Kohlenstoff in der Form von [[Graphen]] besitzt nochmals eine höhere Leitfähigkeit) und der höchsten [[Wärmeleitfähigkeit|thermischen Leitfähigkeit]] aller [[Metalle]]. Lediglich [[Suprafluidität|Supraflüssigkeiten]] und ungestörte kristalline Ausprägungen des [[Kohlenstoff]]s ([[Diamant]], Graphen und graphennaher [[Graphit]], [[Kohlenstoffnanoröhren]]) und des [[Bornitrid]]s weisen eine bessere thermische Leitfähigkeit auf.<ref>[http://www.tf.uni-kiel.de/matwis/amat/mw2_ge/kap_1/backbone/r1_2_2.html ''Wärmeleitfähigkeit.''] auf der Webseite der Technischen Fakultät der Uni Kiel.</ref> | + | Es ist ein weiches, gut verformbares ([[Wikipedia:Duktilität|duktiles]]) [[Wikipedia:Schwermetalle|Schwermetall]] mit der höchsten [[Wikipedia:Elektrische Leitfähigkeit|elektrischen Leitfähigkeit]] aller Elemente im unmodifizierten Zustand (Kohlenstoff in der Form von [[Wikipedia:Graphen|Graphen]] besitzt nochmals eine höhere Leitfähigkeit) und der höchsten [[Wikipedia:Wärmeleitfähigkeit|thermischen Leitfähigkeit]] aller [[Wikipedia:Metalle|Metalle]]. Lediglich [[Wikipedia:Suprafluidität|Supraflüssigkeiten]] und ungestörte kristalline Ausprägungen des [[Kohlenstoff]]s ([[Wikipedia:Diamant|Diamant]], Graphen und graphennaher [[Wikipedia:Graphit|Graphit]], [[Wikipedia:Kohlenstoffnanoröhren|Kohlenstoffnanoröhren]]) und des [[Wikipedia:Bornitrid|Bornitrid]]s weisen eine bessere thermische Leitfähigkeit auf.<ref>[http://www.tf.uni-kiel.de/matwis/amat/mw2_ge/kap_1/backbone/r1_2_2.html ''Wärmeleitfähigkeit.''] auf der Webseite der Technischen Fakultät der Uni Kiel.</ref> |
| − | == Etymologie == | + | ==Etymologie== |
| − | Das Wort „Silber“ ({{gohS|silabar, silbar}} und ähnliche Formen) leitet sich aus der [[gemeingermanisch]]en Wurzel ''*silubra-'' ab, ebenso wie die Bezeichnungen in anderen germanischen Sprachen (so Englisch ''{{lang|en|silver}}''). Das [[Baskische Sprache|Baskische]] hat das germanische Wort übernommen. Verwandte Bezeichnungen gibt es in den [[Baltische Sprachen|baltischen Sprachen]] und den [[Slawische Sprachen|slawischen Sprachen]]. | + | Das Wort „Silber“ ({{gohS|silabar, silbar}} und ähnliche Formen) leitet sich aus der [[Wikipedia:gemeingermanisch|gemeingermanisch]]en Wurzel ''*silubra-'' ab, ebenso wie die Bezeichnungen in anderen germanischen Sprachen (so Englisch ''{{lang|en|silver}}''). Das [[Wikipedia:Baskische Sprache|Baskische]] hat das germanische Wort übernommen: ''{{lang|eu|zilar}}''. Verwandte Bezeichnungen gibt es in den [[Wikipedia:Baltische Sprachen|baltischen Sprachen]] ({{ltS|sidabras}}) und den [[Wikipedia:Slawische Sprachen|slawischen Sprachen]] ({{ruS|серебро|serebro}}, {{hrS|srebro}}).<ref name="DWB">Vgl. [http://woerterbuchnetz.de/DWB/?sigle=DWB&mode=Vernetzung&hitlist=&patternlist=&lemid=GS28467#XGS28467 ''Silber''] im [[Wikipedia:Deutsches Wörterbuch|Deutschen Wörterbuch]] der Brüder Grimm</ref> |
| − | Die [[Philologie]] des 19. Jahrhunderts brachte eine Vielzahl von Theorien über den Wortursprung hervor. | + | Die [[Wikipedia:Philologie|Philologie]] des 19. Jahrhunderts brachte eine Vielzahl von Theorien über den Wortursprung hervor.<ref name="DWB" /> Der 1870 von [[Wikipedia:Victor Hehn|Victor Hehn]] hergestellte Zusammenhang mit dem in Homers [[Wikipedia:Ilias|Ilias]] beschriebenen sagenhaften Land ''Alybē'' ({{lang|grc|Ἀλύβη}}) muss Spekulation bleiben. Das Wort könnte aus einer orientalischen Sprache stammen, abgeleitet von der [[Wikipedia:Semitische Sprachen|semitischen]] Wurzel ṢRP (vgl. [[Wikipedia:Akkadische Sprache|akkadisch]] ''{{lang|akk|ṣarāpu}}'', „veredeln, legieren“).<ref>Vgl. [http://www.etymonline.com/index.php?term=silver Online Etymology Dictionary] zu Englisch ''silver''.</ref> |
| − | In anderen [[Indogermanische Sprachen|indogermanischen Sprachen]] geht das Wort für Silber auf die [[Wurzel (Linguistik)|Wurzel]] ''*arg'' zurück, so {{grcS|ἄργυρος|argyros}} und {{laS|argentum}}.<ref>Vgl. [http://www.etymonline.com/index.php?term=argent Online Etymology Dictionary] zu Englisch ''{{lang|en|argent}}'' (für Silber als [[Tingierung|heraldische Farbe]]).</ref> [[Argentinien]] wurde nach dem Silber benannt, das Europäer dort zu finden hofften; es ist das einzige nach einem chemischen Element benannte Land. Häufiger ist die Namensgebung eines Elementes nach einem Land, z. B. [[Francium]], [[Germanium]] und [[Polonium]].<ref name="Holleman1995">{{Holleman-Wiberg|Auflage=102 |Startseite=1452 |Endseite=1466 }}</ref> | + | In anderen [[Wikipedia:Indogermanische Sprachen|indogermanischen Sprachen]] geht das Wort für Silber auf die [[Wikipedia:Wurzel (Linguistik)|Wurzel]] ''*arg'' zurück, so {{grcS|ἄργυρος|argyros}} und {{laS|argentum}}.<ref>Vgl. [http://www.etymonline.com/index.php?term=argent Online Etymology Dictionary] zu Englisch ''{{lang|en|argent}}'' (für Silber als [[Wikipedia:Tingierung|heraldische Farbe]]).</ref> [[Wikipedia:Argentinien|Argentinien]] wurde nach dem Silber benannt, das Europäer dort zu finden hofften; es ist das einzige nach einem chemischen Element benannte Land. Häufiger ist die Namensgebung eines Elementes nach einem Land, z. B. [[Wikipedia:Francium|Francium]], [[Wikipedia:Germanium|Germanium]] und [[Wikipedia:Polonium|Polonium]].<ref name="Holleman1995">{{Holleman-Wiberg|Auflage=102 |Startseite=1452 |Endseite=1466 }}</ref> |
| − | == Geschichte == | + | ==Geschichte== |
| − | Silber wird von Menschen etwa seit dem [[5. Jahrtausend v. Chr.]] verarbeitet. Es wurde zum Beispiel von den [[Assyrer]]n, den [[Goten]], den [[Griechen]], den [[Römisches Reich|Römern]], den [[Altes Ägypten|Ägyptern]] und den [[Germanen]] benutzt. Zeitweise galt es als wertvoller als [[Gold]]. Das Silber stammte meistens aus den [[Bergwerk|Minen]] in [[Laurion]], die etwa 50 Kilometer südlich von [[Athen]] lagen. Bei den alten Ägyptern war Silber als Mondmetall bekannt. | + | Silber wird von Menschen etwa seit dem [[Wikipedia:5. Jahrtausend v. Chr.|5. Jahrtausend v. Chr.]] verarbeitet. Es wurde zum Beispiel von den [[Wikipedia:Assyrer|Assyrer]]n, den [[Wikipedia:Goten|Goten]], den [[Wikipedia:Griechen|Griechen]], den [[Wikipedia:Römisches Reich|Römern]], den [[Wikipedia:Altes Ägypten|Ägyptern]] und den [[Wikipedia:Germanen|Germanen]] benutzt. Zeitweise galt es als wertvoller als [[Gold]]. Das Silber stammte meistens aus den [[Wikipedia:Bergwerk|Minen]] in [[Wikipedia:Laurion|Laurion]], die etwa 50 Kilometer südlich von [[Wikipedia:Athen|Athen]] lagen. Bei den alten Ägyptern war Silber als Mondmetall bekannt. |
| − | Im Mittelalter und der Frühen Neuzeit wurden in Zentraleuropa Silbererzvorkommen im [[Harz (Mittelgebirge)|Harz]] ([[Goslar]]), in [[Landkreis Waldeck-Frankenberg|Waldeck-Frankenberg]] ([[Frankenberg (Eder)|Frankenberg]], [[Goddelsheim]], [[Dorfitter]], [[Thalitter]]), am [[Donnersberg]] ([[Imsbach]]), im [[Thüringer Wald]] ([[Ohrdruf]]), in [[Sachsen]] ([[Freiberg]] und im übrigen [[Erzgebirge]], besonders [[Jáchymov]]), im [[Südschwarzwald]] ([[Schauinsland]], [[Belchen (Schwarzwald)|Belchen]], [[Münstertal/Schwarzwald|Münstertal]], [[Feldberg im Schwarzwald|Feldberg]]), [[Böhmen]] ([[Kutná Hora]]) und der [[Slowakei]] entdeckt. Ergiebige Silbervorkommen sind darüber hinaus aus [[Kongsberg]] (Norwegen) bekannt. | + | Im Mittelalter und der Frühen Neuzeit wurden in Zentraleuropa Silbererzvorkommen im [[Wikipedia:Harz (Mittelgebirge)|Harz]] ([[Wikipedia:Goslar|Goslar]]), in [[Wikipedia:Landkreis Waldeck-Frankenberg|Waldeck-Frankenberg]] ([[Wikipedia:Frankenberg (Eder)|Frankenberg]], [[Wikipedia:Goddelsheim|Goddelsheim]], [[Wikipedia:Dorfitter|Dorfitter]], [[Wikipedia:Thalitter|Thalitter]]), am [[Wikipedia:Donnersberg|Donnersberg]] ([[Wikipedia:Imsbach|Imsbach]]), im [[Wikipedia:Thüringer Wald|Thüringer Wald]] ([[Wikipedia:Ohrdruf|Ohrdruf]]), in [[Wikipedia:Sachsen|Sachsen]] ([[Wikipedia:Freiberg|Freiberg]] und im übrigen [[Wikipedia:Erzgebirge|Erzgebirge]], besonders [[Wikipedia:Jáchymov|Jáchymov]]), im [[Wikipedia:Südschwarzwald|Südschwarzwald]] ([[Wikipedia:Schauinsland|Schauinsland]], [[Wikipedia:Belchen (Schwarzwald)|Belchen]], [[Wikipedia:Münstertal/Schwarzwald|Münstertal]], [[Wikipedia:Feldberg im Schwarzwald|Feldberg]]), [[Wikipedia:Böhmen|Böhmen]] ([[Wikipedia:Kutná Hora|Kutná Hora]]) und der [[Wikipedia:Slowakei|Slowakei]] entdeckt. Ergiebige Silbervorkommen sind darüber hinaus aus [[Wikipedia:Kongsberg|Kongsberg]] (Norwegen) bekannt. |
| − | Größter Silberproduzent im Mittelalter war [[Schwaz]]. Bis zu 80 % des damaligen Silbers kam aus den Stollen der Schwazer [[Knappe (Bergbau)|Knappen]]. | + | Größter Silberproduzent im Mittelalter war [[Wikipedia:Schwaz|Schwaz]]. Bis zu 80 % des damaligen Silbers kam aus den Stollen der Schwazer [[Wikipedia:Knappe (Bergbau)|Knappen]]. |
| − | Später brachten die [[Spanien|Spanier]] große Mengen von Silber aus [[Lateinamerika]], unter anderem aus der sagenumwobenen Mine von [[Potosí]], nach Europa. Auch Japan war im 16. Jahrhundert Silberexporteur. Durch das gestiegene Angebot sank der Silberwert in der Alten Welt. | + | Später brachten die [[Wikipedia:Spanien|Spanier]] große Mengen von Silber aus [[Wikipedia:Lateinamerika|Lateinamerika]], unter anderem aus der sagenumwobenen Mine von [[Wikipedia:Potosí|Potosí]], nach Europa. Auch Japan war im 16. Jahrhundert Silberexporteur. Durch das gestiegene Angebot sank der Silberwert in der Alten Welt. |
Da nach 1870 vorwiegend Gold als Währungsmetall verwendet wurde, verlor das Silber seine wirtschaftliche Bedeutung immer mehr. Das Wertverhältnis sank von 1:14 einige Zeit lang auf 1:100, später stieg es wieder etwas an. Im März 2018 lag es bei ungefähr 1:81. Das Angebot an Silber ist von der Verbrauchs- und Produktionsentwicklung anderer Metalle abhängig. | Da nach 1870 vorwiegend Gold als Währungsmetall verwendet wurde, verlor das Silber seine wirtschaftliche Bedeutung immer mehr. Das Wertverhältnis sank von 1:14 einige Zeit lang auf 1:100, später stieg es wieder etwas an. Im März 2018 lag es bei ungefähr 1:81. Das Angebot an Silber ist von der Verbrauchs- und Produktionsentwicklung anderer Metalle abhängig. | ||
| − | Mitte des 19. Jahrhunderts wurde rostfreier Stahl entwickelt, der dann aufgrund seiner Gebrauchsfreundlichkeit und des attraktiven Preises nach dem [[Erster Weltkrieg|Ersten Weltkrieg]] in die Einsatzbereiche des Silbers vordrang, etwa Servierplatten, Bestecke, Leuchter und Küchengerät. Gegenläufig dazu hat sich der Bereich Fotografie und Fotochemie unter Verwendung der Silbersalze während des ganzen 20. Jahrhunderts breit entwickelt, verlor aber seit Ende der 1990er Jahre im Zuge der Umstellung auf die digitale Abbildungstechnik erheblich an Bedeutung. | + | Mitte des 19. Jahrhunderts wurde rostfreier Stahl entwickelt, der dann aufgrund seiner Gebrauchsfreundlichkeit und des attraktiven Preises nach dem [[Wikipedia:Erster Weltkrieg|Ersten Weltkrieg]] in die Einsatzbereiche des Silbers vordrang, etwa Servierplatten, Bestecke, Leuchter und Küchengerät. Gegenläufig dazu hat sich der Bereich Fotografie und Fotochemie unter Verwendung der Silbersalze während des ganzen 20. Jahrhunderts breit entwickelt, verlor aber seit Ende der 1990er Jahre im Zuge der Umstellung auf die digitale Abbildungstechnik erheblich an Bedeutung. |
| − | Als die größte Silberspekulation wird die Spekulationsblase im Silbermarkt Mitte der 1970er Jahre bis zum Jahr 1980 betrachtet, die insbesondere mit den Brüdern Nelson Bunker Hunt und William Herbert Hunt in Verbindung gebracht wird, die [[Silberspekulation der Brüder Hunt]]. | + | Als die größte Silberspekulation wird die Spekulationsblase im Silbermarkt Mitte der 1970er Jahre bis zum Jahr 1980 betrachtet, die insbesondere mit den Brüdern Nelson Bunker Hunt und William Herbert Hunt in Verbindung gebracht wird, die [[Wikipedia:Silberspekulation der Brüder Hunt|Silberspekulation der Brüder Hunt]]. |
| − | == Silber als Mineral und Varietäten == | + | ==Silber als Mineral und Varietäten== |
| − | [[Datei:Calcite-Silver-art-08c.jpg|mini|links|upright=1.05|Silbergeflecht mit [[Calcit]] aus [[Kongsberg]], Buskerud, Norwegen (6,4 × 4,6 × 0,6 cm³)]] | + | [[Datei:Calcite-Silver-art-08c.jpg|mini|links|upright=1.05|Silbergeflecht mit [[Wikipedia:Calcit|Calcit]] aus [[Wikipedia:Kongsberg|Kongsberg]], Buskerud, Norwegen (6,4 × 4,6 × 0,6 cm³)]] |
[[Datei:Kongsbergit - Coquimbo, Chile.jpg|mini|links|upright=1.05|Kongsbergit aus Coquimbo, Chile]] | [[Datei:Kongsbergit - Coquimbo, Chile.jpg|mini|links|upright=1.05|Kongsbergit aus Coquimbo, Chile]] | ||
| − | Silber hat in der [[Erdkruste]] einen Anteil von etwa 0,079 [[Parts per million|ppm]]. Es ist damit etwa 20 mal häufiger als [[Gold]] und rund 700 mal seltener als [[Kupfer]]. In der Natur tritt es [[gediegen]] auf, das heißt elementar; meist in Form von Körnern, seltener von größeren [[Nugget (Metallurgie)|Nuggets]], dünnen Plättchen und Blechen oder als drahtig verästeltes Geflecht ([[Dendrit (Kristallographie)|Dendrit]]) bzw. als dünne Silberdrähte in hydrothermal gebildeten Erzgängen sowie im Bereich der [[Zementationszone]]. | + | Silber hat in der [[Wikipedia:Erdkruste|Erdkruste]] einen Anteil von etwa 0,079 [[Wikipedia:Parts per million|ppm]]. Es ist damit etwa 20 mal häufiger als [[Gold]] und rund 700 mal seltener als [[Kupfer]]. In der Natur tritt es [[Wikipedia:gediegen|gediegen]] auf, das heißt elementar; meist in Form von Körnern, seltener von größeren [[Wikipedia:Nugget (Metallurgie)|Nuggets]], dünnen Plättchen und Blechen oder als drahtig verästeltes Geflecht ([[Wikipedia:Dendrit (Kristallographie)|Dendrit]]) bzw. als dünne Silberdrähte in hydrothermal gebildeten Erzgängen sowie im Bereich der [[Wikipedia:Zementationszone|Zementationszone]]. |
| − | Natürliche Vorkommen an gediegen Silber waren bereits vor der Gründung der [[International Mineralogical Association]] (IMA) bekannt. Silber ist daher als sogenanntes ''grandfathered'' [[Mineral]] als eigenständige Mineralart anerkannt.<ref>[http://cnmnc.main.jp/IMA_Master_List_%282019-07%29.pdf#page=178 IMA/CNMNC List of Mineral Names; July 2019] (PDF 1,67 MB; Silber siehe S. 178)</ref> | + | Natürliche Vorkommen an gediegen Silber waren bereits vor der Gründung der [[Wikipedia:International Mineralogical Association|International Mineralogical Association]] (IMA) bekannt. Silber ist daher als sogenanntes ''grandfathered'' [[Wikipedia:Mineral|Mineral]] als eigenständige Mineralart anerkannt.<ref>[http://cnmnc.main.jp/IMA_Master_List_%282019-07%29.pdf#page=178 IMA/CNMNC List of Mineral Names; July 2019] (PDF 1,67 MB; Silber siehe S. 178)</ref> |
| − | Gemäß der [[Systematik der Minerale nach Strunz (9. Auflage)#A. Kupfer-Cupalit-Familie|Systematik der Minerale nach Strunz (9. Auflage)]] wird Silber unter der System-Nr. „1.AA.05“ (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe)<ref>[http://cnmnc.main.jp/IMA2009-01%20UPDATE%20160309.pdf#page=260 IMA/CNMNC List of Mineral Names; 2009] (PDF 1,8 MB, Silber siehe S. 260).</ref> beziehungsweise in der veralteten [[Systematik der Minerale nach Strunz (8. Auflage)#I/A. Metalle und intermetallische Legierungen (ohne Halbmetalle)|8. Auflage]] unter ''I/A.01'' (Kupfer-Reihe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete [[Systematik der Minerale nach Dana/Elemente#01.01 Elemente: Metallische Elemente außer der Platingruppe|Systematik der Minerale nach Dana]] führt das Element-Mineral unter der System-Nr. „01.01.01.02“ (Goldgruppe).<ref>[http://webmineral.com/dana/dana.php?class=01&subclass=01&group=01 Webmineral – Minerals Arranged by the New Dana Classification. 01.01.01 Gold group].</ref> | + | Gemäß der [[Wikipedia:Systematik der Minerale nach Strunz (9. Auflage)#A. Kupfer-Cupalit-Familie|Systematik der Minerale nach Strunz (9. Auflage)]] wird Silber unter der System-Nr. „1.AA.05“ (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe)<ref>[http://cnmnc.main.jp/IMA2009-01%20UPDATE%20160309.pdf#page=260 IMA/CNMNC List of Mineral Names; 2009] (PDF 1,8 MB, Silber siehe S. 260).</ref> beziehungsweise in der veralteten [[Wikipedia:Systematik der Minerale nach Strunz (8. Auflage)#I/A. Metalle und intermetallische Legierungen (ohne Halbmetalle)|8. Auflage]] unter ''I/A.01'' (Kupfer-Reihe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete [[Systematik der Minerale nach Dana/Elemente#01.01 Elemente: Metallische Elemente außer der Platingruppe|Systematik der Minerale nach Dana]] führt das Element-Mineral unter der System-Nr. „01.01.01.02“ (Goldgruppe).<ref>[http://webmineral.com/dana/dana.php?class=01&subclass=01&group=01 Webmineral – Minerals Arranged by the New Dana Classification. 01.01.01 Gold group].</ref> |
| − | Neben gediegen Silber, von dem bisher (Stand: 2018) über 5500 Fundorte dokumentiert sind,<ref>[https://www.mindat.org/show.php?id=3664&ld=1#themap Mindat - Silver] (englisch).</ref> findet man es vor allem in [[sulfid]]ischen Mineralen. Zu den wichtigsten sulfidischen Silbererzen zählen unter anderem [[Akanthit]] (''Silberglanz'') Ag<sub>2</sub>S mit einem Silbergehalt von etwa 87 % und [[Stromeyerit]] (''Kupfersilberglanz'') CuAgS mit etwa 53 % Silberanteil. Das Mineral mit dem höchsten Silberanteil von maximal 99 % ist allerdings das selten vorkommende [[Allargentum]]. Ebenfalls selten vorkommende Silberminerale sind unter anderem der [[Chlorargyrit]] (veraltet ''Hornerz'' bzw. ''Silberhornerz'') AgCl und der [[Miargyrit]] (''Silberantimonglanz'') AgSbS<sub>2</sub>. Insgesamt sind einschließlich gediegen Silber bisher (Stand: 2018) 167 Silberminerale bekannt.<ref>[http://webmineral.com/chem/Chem-Ag.shtml ''Mineral Species containing Silver (Ag).''] auf: ''webmineral.com''.</ref> | + | Neben gediegen Silber, von dem bisher (Stand: 2018) über 5500 Fundorte dokumentiert sind,<ref>[https://www.mindat.org/show.php?id=3664&ld=1#themap Mindat - Silver] (englisch).</ref> findet man es vor allem in [[Wikipedia:sulfid|sulfid]]ischen Mineralen. Zu den wichtigsten sulfidischen Silbererzen zählen unter anderem [[Wikipedia:Akanthit|Akanthit]] (''Silberglanz'') Ag<sub>2</sub>S mit einem Silbergehalt von etwa 87 % und [[Wikipedia:Stromeyerit|Stromeyerit]] (''Kupfersilberglanz'') CuAgS mit etwa 53 % Silberanteil. Das Mineral mit dem höchsten Silberanteil von maximal 99 % ist allerdings das selten vorkommende [[Wikipedia:Allargentum|Allargentum]]. Ebenfalls selten vorkommende Silberminerale sind unter anderem der [[Wikipedia:Chlorargyrit|Chlorargyrit]] (veraltet ''Hornerz'' bzw. ''Silberhornerz'') AgCl und der [[Wikipedia:Miargyrit|Miargyrit]] (''Silberantimonglanz'') AgSbS<sub>2</sub>. Insgesamt sind einschließlich gediegen Silber bisher (Stand: 2018) 167 Silberminerale bekannt.<ref>[http://webmineral.com/chem/Chem-Ag.shtml ''Mineral Species containing Silver (Ag).''] auf: ''webmineral.com''.</ref> |
| − | Neben diesen Silbererzen findet man noch sogenannte silberhaltige Erze, die meist nur geringe Mengen Silber (0,01–1 %) enthalten. Dies sind häufig [[Galenit]] (PbS) und [[Chalkopyrit]] (CuFeS<sub>2</sub>). Aus diesem Grund wird Silber häufig als Nebenprodukt bei der Blei- oder Kupferherstellung gewonnen. | + | Neben diesen Silbererzen findet man noch sogenannte silberhaltige Erze, die meist nur geringe Mengen Silber (0,01–1 %) enthalten. Dies sind häufig [[Wikipedia:Galenit|Galenit]] (PbS) und [[Wikipedia:Chalkopyrit|Chalkopyrit]] (CuFeS<sub>2</sub>). Aus diesem Grund wird Silber häufig als Nebenprodukt bei der Blei- oder Kupferherstellung gewonnen. |
| − | Ein als ''Kongsbergit'' bezeichnetes Silber[[amalgam]] mit einem [[Quecksilber]]gehalt von etwa 5 % wird als [[Varietät (Mineralogie)|Varietät]] dem Silber zugerechnet. Bekannt ist Kongsbergit bisher von etwas mehr als 30 Fundorten.<ref>[https://www.mindat.org/show.php?id=2250&ld=1#themap Mindat - Kongsbergite].</ref> | + | Ein als ''Kongsbergit'' bezeichnetes Silber[[Wikipedia:amalgam|amalgam]] mit einem [[Quecksilber]]gehalt von etwa 5 % wird als [[Wikipedia:Varietät (Mineralogie)|Varietät]] dem Silber zugerechnet. Bekannt ist Kongsbergit bisher von etwas mehr als 30 Fundorten.<ref>[https://www.mindat.org/show.php?id=2250&ld=1#themap Mindat - Kongsbergite].</ref> |
Als ''Arquerit'' wird eine Silbervarietät (''Silberamalgam'') mit einem Quecksilbergehalt von 10 bis 15 % bezeichnet.<ref name="Lapis">{{Literatur |Autor=Stefan Weiß |Titel=Das große Lapis Mineralienverzeichnis. Alle Mineralien von A – Z und ihre Eigenschaften |Auflage=6., vollkommen neu bearbeitete und ergänzte |Verlag=Weise |Ort=München |Datum=2014 |ISBN=978-3-921656-80-8}}</ref> | Als ''Arquerit'' wird eine Silbervarietät (''Silberamalgam'') mit einem Quecksilbergehalt von 10 bis 15 % bezeichnet.<ref name="Lapis">{{Literatur |Autor=Stefan Weiß |Titel=Das große Lapis Mineralienverzeichnis. Alle Mineralien von A – Z und ihre Eigenschaften |Auflage=6., vollkommen neu bearbeitete und ergänzte |Verlag=Weise |Ort=München |Datum=2014 |ISBN=978-3-921656-80-8}}</ref> | ||
| − | ''Chilenit'' ist eine [[bismut]]haltige Silbervarietät.<ref name="Lapis" /> | + | ''Chilenit'' ist eine [[Wikipedia:bismut|bismut]]haltige Silbervarietät.<ref name="Lapis" /> |
Eine Silbervarietät mit einem Gehalt zwischen 10 und 30 % [[Gold]] ist unter der Bezeichnung ''Küstelit'' bekannt und konnte bisher (Stand: 2011) an rund 60 Fundorten nachgewiesen werden.<ref>[https://www.mindat.org/min-27293.html Mindat - Küstelite].</ref> | Eine Silbervarietät mit einem Gehalt zwischen 10 und 30 % [[Gold]] ist unter der Bezeichnung ''Küstelit'' bekannt und konnte bisher (Stand: 2011) an rund 60 Fundorten nachgewiesen werden.<ref>[https://www.mindat.org/min-27293.html Mindat - Küstelite].</ref> | ||
| − | Seit dem 18. Jahrhundert ist bekannt, dass durch Erhitzen von Akanthit bzw. bei Verhüttungsprozessen von Silbererzen künstlich ([[anthropogen]]) erzeugte Silberdrähte, meist in Form von Silberlocken entstehen können.<ref>[[Mineralienatlas]]: [http://www.mineralienatlas.de/lexikon/index.php/Mineralienportrait/Silber/Anthropogene%20Silberlocken Anthropogene Silberlocken]</ref> Besonders in den letzten Jahrzehnten wurde wiederholt über die künstliche Erzeugung von Silberlocken auf Akanthitstufen<ref>S. Jahn: ''Lockensilber aus Imiter - echt oder eine Fälschung?'' In: ''[[Min. Welt]].'' Heft 6, 2008, S. 28–31.</ref> in der Fachliteratur berichtet. | + | Seit dem 18. Jahrhundert ist bekannt, dass durch Erhitzen von Akanthit bzw. bei Verhüttungsprozessen von Silbererzen künstlich ([[Wikipedia:anthropogen|anthropogen]]) erzeugte Silberdrähte, meist in Form von Silberlocken entstehen können.<ref>[[Wikipedia:Mineralienatlas|Mineralienatlas]]: [http://www.mineralienatlas.de/lexikon/index.php/Mineralienportrait/Silber/Anthropogene%20Silberlocken Anthropogene Silberlocken]</ref> Besonders in den letzten Jahrzehnten wurde wiederholt über die künstliche Erzeugung von Silberlocken auf Akanthitstufen<ref>S. Jahn: ''Lockensilber aus Imiter - echt oder eine Fälschung?'' In: ''[[Min. Welt]].'' Heft 6, 2008, S. 28–31.</ref> in der Fachliteratur berichtet. |
| − | == Vorkommen und Förderung == | + | ==Vorkommen und Förderung== |
| − | Die wichtigsten Silbervorkommen befinden sich in Nordamerika ([[Mexiko]], den [[Vereinigte Staaten|USA]] und [[Kanada]]) und in Südamerika ([[Peru]], [[Bolivien]]). | + | Die wichtigsten Silbervorkommen befinden sich in Nordamerika ([[Wikipedia:Mexiko|Mexiko]], den [[Wikipedia:Vereinigte Staaten|USA]] und [[Wikipedia:Kanada|Kanada]]) und in Südamerika ([[Wikipedia:Peru|Peru]], [[Wikipedia:Bolivien|Bolivien]]). |
Mit knapp 20 % der globalen Förderung war Peru von 2003 bis 2009 der weltweit größte Silberproduzent und wurde 2010 von Mexiko überholt.<ref>United States Geological Survey: [https://www.usgs.gov/centers/nmic/silver-statistics-and-information Silver Statistics and Information]</ref> Im Jahr 2017 förderte Mexiko mit 6110 t weltweit das meiste Silber, gefolgt von Peru mit 4300 t.<ref name="USGS2019">United States Geological Survey: [https://prd-wret.s3-us-west-2.amazonaws.com/assets/palladium/production/atoms/files/mcs-2019-silve.pdf World Mine Production and Reserves January 2019]</ref> | Mit knapp 20 % der globalen Förderung war Peru von 2003 bis 2009 der weltweit größte Silberproduzent und wurde 2010 von Mexiko überholt.<ref>United States Geological Survey: [https://www.usgs.gov/centers/nmic/silver-statistics-and-information Silver Statistics and Information]</ref> Im Jahr 2017 förderte Mexiko mit 6110 t weltweit das meiste Silber, gefolgt von Peru mit 4300 t.<ref name="USGS2019">United States Geological Survey: [https://prd-wret.s3-us-west-2.amazonaws.com/assets/palladium/production/atoms/files/mcs-2019-silve.pdf World Mine Production and Reserves January 2019]</ref> | ||
| − | Das meiste Silber wird aus Silbererzen gewonnen, die oft zusammen mit Blei-, Kupfer- und Zinkerzen als [[Sulfide]] oder [[Oxide]] vorkommen. Wichtige Fundorte von Silber in [[gediegen]]er Form waren: [[Freiberger Gangerzlagerstätte|Freiberg]] im [[Erzgebirge]]; [[Silberbergwerk Schwaz|Schwaz (Tirol)]]; [[Kongsberg (Silbererz-Lagerstätte)|Kongsberg]]/Norwegen (dort auch große Kristalle); [[Sankt Andreasberg]] im Harz; [[Keweenaw-Halbinsel]]/USA (dort mit ebenfalls gediegen vorkommendem Kupfer als „halfbreed“); [[Batopilas]]/Mexiko; Mansfelder Kupferschiefer-Revier ([[Eisleben]], [[Sangerhausen]]; meist Silberbleche; auch als Versteinerungsmaterial von Fossilien). | + | Das meiste Silber wird aus Silbererzen gewonnen, die oft zusammen mit Blei-, Kupfer- und Zinkerzen als [[Wikipedia:Sulfide|Sulfide]] oder [[Wikipedia:Oxide|Oxide]] vorkommen. Wichtige Fundorte von Silber in [[Wikipedia:gediegen|gediegen]]er Form waren: [[Wikipedia:Freiberger Gangerzlagerstätte|Freiberg]] im [[Wikipedia:Erzgebirge|Erzgebirge]]; [[Wikipedia:Silberbergwerk Schwaz|Schwaz (Tirol)]]; [[Wikipedia:Kongsberg (Silbererz-Lagerstätte)|Kongsberg]]/Norwegen (dort auch große Kristalle); [[Wikipedia:Sankt Andreasberg|Sankt Andreasberg]] im Harz; [[Wikipedia:Keweenaw-Halbinsel|Keweenaw-Halbinsel]]/USA (dort mit ebenfalls gediegen vorkommendem Kupfer als „halfbreed“); [[Wikipedia:Batopilas|Batopilas]]/Mexiko; Mansfelder Kupferschiefer-Revier ([[Wikipedia:Eisleben|Eisleben]], [[Wikipedia:Sangerhausen|Sangerhausen]]; meist Silberbleche; auch als Versteinerungsmaterial von Fossilien). |
| − | Zwischen dem Beginn des 20. Jahrhunderts und dem Ende des [[Zweiter Weltkrieg|Zweiten Weltkrieges]] hat die jährlich geförderte Silbermenge zwar fluktuiert, ist aber im Mittel konstant geblieben. Vom Kriegsende bis heute hat sie sich mehr als verdoppelt. | + | Zwischen dem Beginn des 20. Jahrhunderts und dem Ende des [[Wikipedia:Zweiter Weltkrieg|Zweiten Weltkrieges]] hat die jährlich geförderte Silbermenge zwar fluktuiert, ist aber im Mittel konstant geblieben. Vom Kriegsende bis heute hat sie sich mehr als verdoppelt. |
| − | Das polnische Unternehmen [[KGHM]] ist mit durchschnittlich 1.200 Tonnen [[Jahresförderung]] das bedeutendste Silberunternehmen der EU und das drittgrößte weltweit. | + | Das polnische Unternehmen [[Wikipedia:KGHM|KGHM]] ist mit durchschnittlich 1.200 Tonnen [[Wikipedia:Jahresförderung|Jahresförderung]] das bedeutendste Silberunternehmen der EU und das drittgrößte weltweit. |
| − | Laut einer Studie des [[Rheinisch-Westfälisches Institut für Wirtschaftsforschung|Rheinisch-Westfälischen Instituts für Wirtschaftsforschung]], des [[Fraunhofer-Institut für System- und Innovationsforschung|Fraunhofer-Instituts für System- und Innovationsforschung]] sowie der [[Bundesanstalt für Geowissenschaften und Rohstoffe]] beträgt die weltweite Reichweite der Silberressourcen nur noch 29 Jahre. Somit ist mit einer Verknappung von Silber in den nächsten Jahrzehnten zu rechnen. Allerdings wird auch immer mehr Silber [[Recycling|recycelt]], wodurch die bekannten Vorkommen geschont werden.<ref>[http://www.rwi-essen.de/media/content/pages/publikationen/rwi-projektberichte/PB_Mineralische-Riohstoffe.pdf ''Trends der Angebots- und Nachfragesituation bei mineralischen Rohstoffen.''] (PDF; 2,1 MB), [[Rheinisch-Westfälisches Institut für Wirtschaftsforschung]] (RWI Essen), [[Fraunhofer-Institut für System- und Innovationsforschung]] (ISI), [[Bundesanstalt für Geowissenschaften und Rohstoffe]] (BGR).</ref> Ausgehend von den Daten des [[United States Geological Survey|U.S. Geological Survey]] vom Januar 2019<ref name="USGS2019" /> ergibt sich für Silber in Bezug auf das Jahr 2017 eine [[statische Reichweite]] von 21 Jahren. | + | Laut einer Studie des [[Wikipedia:Rheinisch-Westfälisches Institut für Wirtschaftsforschung|Rheinisch-Westfälischen Instituts für Wirtschaftsforschung]], des [[Wikipedia:Fraunhofer-Institut für System- und Innovationsforschung|Fraunhofer-Instituts für System- und Innovationsforschung]] sowie der [[Wikipedia:Bundesanstalt für Geowissenschaften und Rohstoffe|Bundesanstalt für Geowissenschaften und Rohstoffe]] beträgt die weltweite Reichweite der Silberressourcen nur noch 29 Jahre. Somit ist mit einer Verknappung von Silber in den nächsten Jahrzehnten zu rechnen. Allerdings wird auch immer mehr Silber [[Wikipedia:Recycling|recycelt]], wodurch die bekannten Vorkommen geschont werden.<ref>[http://www.rwi-essen.de/media/content/pages/publikationen/rwi-projektberichte/PB_Mineralische-Riohstoffe.pdf ''Trends der Angebots- und Nachfragesituation bei mineralischen Rohstoffen.''] (PDF; 2,1 MB), [[Wikipedia:Rheinisch-Westfälisches Institut für Wirtschaftsforschung|Rheinisch-Westfälisches Institut für Wirtschaftsforschung]] (RWI Essen), [[Wikipedia:Fraunhofer-Institut für System- und Innovationsforschung|Fraunhofer-Institut für System- und Innovationsforschung]] (ISI), [[Wikipedia:Bundesanstalt für Geowissenschaften und Rohstoffe|Bundesanstalt für Geowissenschaften und Rohstoffe]] (BGR).</ref> Ausgehend von den Daten des [[Wikipedia:United States Geological Survey|U.S. Geological Survey]] vom Januar 2019<ref name="USGS2019" /> ergibt sich für Silber in Bezug auf das Jahr 2017 eine [[Wikipedia:statische Reichweite|statische Reichweite]] von 21 Jahren. |
| − | Wie bei den anderen Edelmetallen spielt die Wiederaufarbeitung silberhaltiger Materialien im Rahmen des [[Recycling]]s, beispielsweise von [[Fotopapier]]en, [[Röntgenfilm]]en, Entwickler- und Fixierbädern, [[Elektronikschrott]] und [[Batterie (Elektrotechnik)|Batterien]] eine wichtige Rolle. | + | Wie bei den anderen Edelmetallen spielt die Wiederaufarbeitung silberhaltiger Materialien im Rahmen des [[Wikipedia:Recycling|Recycling]]s, beispielsweise von [[Wikipedia:Fotopapier|Fotopapier]]en, [[Wikipedia:Röntgenfilm|Röntgenfilm]]en, Entwickler- und Fixierbädern, [[Wikipedia:Elektronikschrott|Elektronikschrott]] und [[Wikipedia:Batterie (Elektrotechnik)|Batterien]] eine wichtige Rolle. |
[[Datei:World Silver Production 2011.svg|mini|Weltweite Silberproduktion (2011)]] | [[Datei:World Silver Production 2011.svg|mini|Weltweite Silberproduktion (2011)]] | ||
| Zeile 66: | Zeile 66: | ||
{| class="wikitable" style="text-align:center;" | {| class="wikitable" style="text-align:center;" | ||
| − | |+ Die Staaten mit der größten Förderung weltweit (2017)<ref name="USGS2019" /> | + | |+Die Staaten mit der größten Förderung weltweit (2017)<ref name="USGS2019" /> |
|- | |- | ||
| − | ! Rang | + | !Rang |
| − | ! Land | + | !Land |
| − | ! Fördermengen<br /><small>(in [[Tonne (Einheit)|t]])</small> | + | !Fördermengen<br /><small>(in [[Wikipedia:Tonne (Einheit)|t]])</small> |
! rowspan="7" style="background-color:#FFF;" | | ! rowspan="7" style="background-color:#FFF;" | | ||
| − | ! Rang | + | !Rang |
| − | ! Land | + | !Land |
| − | ! Fördermengen<br /><small>(in [[Tonne (Einheit)|t]])</small> | + | !Fördermengen<br /><small>(in [[Wikipedia:Tonne (Einheit)|t]])</small> |
|- | |- | ||
| − | | 1 || align="left" | {{MEX}} || {{0}}{{0}}6110 || {{0}}7 || align="left" | {{AUS}} || {{0}}{{0}}1200 | + | |1|| align="left" |{{MEX}}||{{0}}{{0}}6110||{{0}}7|| align="left" |{{AUS}}||{{0}}{{0}}1200 |
|- | |- | ||
| − | | 2 || align="left" | {{PER}} || {{0}}{{0}}4300 || {{0}}8 || align="left" | {{RUS}} || {{0}}{{0}}1120 | + | |2|| align="left" |{{PER}}||{{0}}{{0}}4300||{{0}}8|| align="left" |{{RUS}}||{{0}}{{0}}1120 |
|- | |- | ||
| − | | 3 || align="left" | {{CHN}} || {{0}}{{0}}3500 || {{0}}9 || align="left" | {{USA}} || {{0}}{{0}}1030 | + | |3|| align="left" |{{CHN}}||{{0}}{{0}}3500||{{0}}9|| align="left" |{{USA}}||{{0}}{{0}}1030 |
|- | |- | ||
| − | | 4 || align="left" | {{POL}} || {{0}}{{0}}1290 || 10 | + | |4|| align="left" |{{POL}}||{{0}}{{0}}1290||10|| align="left" |{{ARG}}||{{0}}{{0}}1020 |
|- | |- | ||
| − | | 5 || align="left" | {{CHI}} || {{0}}{{0}}1260 || | + | |5|| align="left" |{{CHI}}||{{0}}{{0}}1260|| colspan="2" align="left" |übrige||{{0}}{{0}}4770 |
|- | |- | ||
| − | | 6 || align="left" | {{BOL}} || {{0}}{{0}}1240 || | + | |6|| align="left" |{{BOL}}||{{0}}{{0}}1240|| colspan="2" align="left" |Summe||{{0}}26800 |
|- | |- | ||
|} | |} | ||
| Zeile 92: | Zeile 92: | ||
{{Absatz}} | {{Absatz}} | ||
| − | == Gewinnung und Darstellung == | + | ==Gewinnung und Darstellung== |
| − | === Gewinnung aus Silbererzen === | + | ===Gewinnung aus Silbererzen=== |
| − | 20 % des Silbers wird aus Silbererzen gewonnen<!-- Im vorigen Abschnitt steht "das meiste Silber wird aus Erzen gewonnen"-->. Aus diesen wird das Silber meist durch [[Gold#Cyanidlaugung|Cyanidlaugung]] mit Hilfe einer 0,1%igen [[Natriumcyanid]]-Lösung herausgelöst. Dazu wird das Erz zunächst fein zu einem [[Schlamm]] zerkleinert. Anschließend wird die Natriumcyanid-Lösung dazugegeben. Dabei ist eine gute Belüftung wichtig, da für das Verfahren [[Sauerstoff]] benötigt wird. | + | 20 % des Silbers wird aus Silbererzen gewonnen<!-- Im vorigen Abschnitt steht "das meiste Silber wird aus Erzen gewonnen"-->. Aus diesen wird das Silber meist durch [[Gold#Cyanidlaugung|Cyanidlaugung]] mit Hilfe einer 0,1%igen [[Wikipedia:Natriumcyanid|Natriumcyanid]]-Lösung herausgelöst. Dazu wird das Erz zunächst fein zu einem [[Wikipedia:Schlamm|Schlamm]] zerkleinert. Anschließend wird die Natriumcyanid-Lösung dazugegeben. Dabei ist eine gute Belüftung wichtig, da für das Verfahren [[Sauerstoff]] benötigt wird. |
Bei der Zugabe von Natriumcyanid gehen sowohl elementares Silber als auch Silbererze (Ag<sub>2</sub>S, AgCl) als [[Dicyanoargentat(I)]] [Ag(CN)<sub>2</sub>]<sup>−</sup> in Lösung: | Bei der Zugabe von Natriumcyanid gehen sowohl elementares Silber als auch Silbererze (Ag<sub>2</sub>S, AgCl) als [[Dicyanoargentat(I)]] [Ag(CN)<sub>2</sub>]<sup>−</sup> in Lösung: | ||
| + | |||
:<math>\mathrm{2\ Ag + H_2O +\ ^1/_2\ O_2 + 4\ NaCN \rightarrow\ 2\ Na[Ag(CN)_2]\ +\ 2\ NaOH}</math>, | :<math>\mathrm{2\ Ag + H_2O +\ ^1/_2\ O_2 + 4\ NaCN \rightarrow\ 2\ Na[Ag(CN)_2]\ +\ 2\ NaOH}</math>, | ||
:<math>\mathrm{ Ag_2S\ + 4\ NaCN \rightarrow\ 2\ Na[Ag(CN)_2]\ +\ Na_2S}</math>, | :<math>\mathrm{ Ag_2S\ + 4\ NaCN \rightarrow\ 2\ Na[Ag(CN)_2]\ +\ Na_2S}</math>, | ||
| Zeile 102: | Zeile 103: | ||
Da die Reaktion von Natriumcyanid mit Silbersulfid in einem Gleichgewicht steht, muss das Natriumsulfid entweder durch Oxidation mit Sauerstoff oder durch Fällung (z. B. als Bleisulfid) entfernt werden. Anschließend fällt man das edlere Silber – ähnlich wie bei der Goldgewinnung – mit [[Zink]] aus: | Da die Reaktion von Natriumcyanid mit Silbersulfid in einem Gleichgewicht steht, muss das Natriumsulfid entweder durch Oxidation mit Sauerstoff oder durch Fällung (z. B. als Bleisulfid) entfernt werden. Anschließend fällt man das edlere Silber – ähnlich wie bei der Goldgewinnung – mit [[Zink]] aus: | ||
| + | |||
:<math>\mathrm{2\ Na[Ag(CN)_2]\ + Zn \rightarrow\ Na_2[Zn(CN)_4] +\ 2\ Ag}</math>. | :<math>\mathrm{2\ Na[Ag(CN)_2]\ + Zn \rightarrow\ Na_2[Zn(CN)_4] +\ 2\ Ag}</math>. | ||
| − | Das ausgefallene Rohsilber (''Werksilber''<ref>Jörg Mildenberger: ''Anton Trutmanns Arzneibuch Teil II: Wörterbuch, Band V.'' Würzburg 1997, ISBN 3-8260-1398-0, S. 2274.</ref>) wird abgefiltert und weiter gereinigt (siehe [[Raffination#Metalle|Raffination]]). | + | Das ausgefallene Rohsilber (''Werksilber''<ref>Jörg Mildenberger: ''Anton Trutmanns Arzneibuch Teil II: Wörterbuch, Band V.'' Würzburg 1997, ISBN 3-8260-1398-0, S. 2274.</ref>) wird abgefiltert und weiter gereinigt (siehe [[Wikipedia:Raffination#Metalle|Raffination]]). |
| − | === Gewinnung aus Bleierzen === | + | ===Gewinnung aus Bleierzen=== |
| − | Bei der Gewinnung von Bleierzen, z. B. aus [[Bleiglanz]], entsteht nach dem Rösten und Reduzieren das sogenannte Rohblei oder [[Werkblei]] (genauere Informationen zur Bleigewinnung im Artikel [[Blei]]). Dieses enthält meist noch einen Anteil Silber (zwischen 0,01 und 1 %). Im nächsten Schritt wird nun das Edelmetall entfernt und so dieses wertvolle Nebenprodukt gewonnen. | + | Bei der Gewinnung von Bleierzen, z. B. aus [[Wikipedia:Bleiglanz|Bleiglanz]], entsteht nach dem Rösten und Reduzieren das sogenannte Rohblei oder [[Wikipedia:Werkblei|Werkblei]] (genauere Informationen zur Bleigewinnung im Artikel [[Blei]]). Dieses enthält meist noch einen Anteil Silber (zwischen 0,01 und 1 %). Im nächsten Schritt wird nun das Edelmetall entfernt und so dieses wertvolle Nebenprodukt gewonnen. |
| − | Zur Gewinnung muss zunächst das Silber vom größten Teil des Bleis getrennt werden. Dies geschieht durch das Verfahren des ''Parkesierens'' (nach [[Alexander Parkes]], der dieses Verfahren 1842 erfand).<ref>[http://plasticker.de/fachwissen/history_people_detail.php?id=1&PHPSESSID=31cd0492cbfeb5dc078deec4294b4c2b ''Geschichte des Kunststoffs - Alexander Parkes.''] auf: ''plasticker.de''</ref> Das Verfahren beruht auf der unterschiedlichen [[Löslichkeit]] von Silber und Blei in [[Zink]]. Bei Temperaturen bis 400 °C sind Blei (flüssig) und Zink (fest) praktisch nicht mischbar. Zunächst wird bei Temperaturen >400 °C zum geschmolzenen Blei Zink gegeben. Danach wird die Mischung abgekühlt. Da Silber im geschmolzenen Zink leicht löslich ist, geht es in die Zinkphase über. Anschließend erstarrt die Zinkschmelze als so genannter ''Zinkschaum'' (Zink-Silber-Mischkristalle). Dadurch kann das Silber vom größten Teil des Bleis getrennt werden. Dieser Zinkschaum wird auch als ''Armblei'' bezeichnet. Er wird anschließend bis zum Schmelzpunkt des Bleis (327 °C) erhitzt, so dass ein Teil des Bleis schmilzt und entfernt werden kann. Danach wird die verbliebene Zink-Blei-Silber-Schmelze bis zum Siedepunkt des Zinks (908 °C) erhitzt und das Zink abdestilliert. Das so gewonnene Produkt wird ''Reichblei'' genannt und enthält etwa 8–12 % Silber. | + | Zur Gewinnung muss zunächst das Silber vom größten Teil des Bleis getrennt werden. Dies geschieht durch das Verfahren des ''Parkesierens'' (nach [[Wikipedia:Alexander Parkes|Alexander Parkes]], der dieses Verfahren 1842 erfand).<ref>[http://plasticker.de/fachwissen/history_people_detail.php?id=1&PHPSESSID=31cd0492cbfeb5dc078deec4294b4c2b ''Geschichte des Kunststoffs - Alexander Parkes.''] auf: ''plasticker.de''</ref> Das Verfahren beruht auf der unterschiedlichen [[Wikipedia:Löslichkeit|Löslichkeit]] von Silber und Blei in [[Zink]]. Bei Temperaturen bis 400 °C sind Blei (flüssig) und Zink (fest) praktisch nicht mischbar. Zunächst wird bei Temperaturen >400 °C zum geschmolzenen Blei Zink gegeben. Danach wird die Mischung abgekühlt. Da Silber im geschmolzenen Zink leicht löslich ist, geht es in die Zinkphase über. Anschließend erstarrt die Zinkschmelze als so genannter ''Zinkschaum'' (Zink-Silber-Mischkristalle). Dadurch kann das Silber vom größten Teil des Bleis getrennt werden. Dieser Zinkschaum wird auch als ''Armblei'' bezeichnet. Er wird anschließend bis zum Schmelzpunkt des Bleis (327 °C) erhitzt, so dass ein Teil des Bleis schmilzt und entfernt werden kann. Danach wird die verbliebene Zink-Blei-Silber-Schmelze bis zum Siedepunkt des Zinks (908 °C) erhitzt und das Zink abdestilliert. Das so gewonnene Produkt wird ''Reichblei'' genannt und enthält etwa 8–12 % Silber. |
| − | Um das Silber anzureichern, wird nun die sogenannte ''Treibarbeit'' ([[Läuterung (Metall)|Läuterung]]) durchgeführt. Dazu wird das Reichblei in einem [[Treibofen]] geschmolzen. Dann wird ein [[Luft]]strom durch die Schmelze geleitet. Dabei oxidiert das Blei zu [[Blei(II)-oxid|Bleioxid]], das edle Silber bleibt hingegen unverändert. Das Bleioxid wird laufend abgeleitet und so nach und nach das Blei entfernt. Ist der Bleigehalt des Raffinats so weit gesunken, dass sich auf der Oberfläche der Metallschmelze keine matte Bleioxidschicht mehr bildet, das letzte Oxidhäutchen aufreißt und mithin das darunterliegende glänzende Silber sichtbar werden lässt, spricht man vom ''Silberblick''. Die dann vorliegende Legierung wird [[Blicksilber]] genannt und besteht zu über 95 % aus Silber. | + | Um das Silber anzureichern, wird nun die sogenannte ''Treibarbeit'' ([[Wikipedia:Läuterung (Metall)|Läuterung]]) durchgeführt. Dazu wird das Reichblei in einem [[Wikipedia:Treibofen|Treibofen]] geschmolzen. Dann wird ein [[Luft]]strom durch die Schmelze geleitet. Dabei oxidiert das Blei zu [[Wikipedia:Blei(II)-oxid|Bleioxid]], das edle Silber bleibt hingegen unverändert. Das Bleioxid wird laufend abgeleitet und so nach und nach das Blei entfernt. Ist der Bleigehalt des Raffinats so weit gesunken, dass sich auf der Oberfläche der Metallschmelze keine matte Bleioxidschicht mehr bildet, das letzte Oxidhäutchen aufreißt und mithin das darunterliegende glänzende Silber sichtbar werden lässt, spricht man vom ''Silberblick''. Die dann vorliegende Legierung wird [[Wikipedia:Blicksilber|Blicksilber]] genannt und besteht zu über 95 % aus Silber. |
| − | === Gewinnung aus Kupfererzen === | + | ===Gewinnung aus Kupfererzen=== |
| − | Silber ist auch in [[Kupfer]]erzen enthalten. Bei der Kupferherstellung fällt das Silber – neben anderen Edelmetallen – im sogenannten [[Anodenschlamm]] an. Dieser wird zunächst mit [[Schwefelsäure]] und Luft vom Großteil des noch vorhandenen Kupfers befreit. Anschließend wird er im Ofen oxidierend geschmolzen, wobei enthaltene unedle Metalle in die Schlacke gehen und entfernt werden können. | + | Silber ist auch in [[Kupfer]]erzen enthalten. Bei der Kupferherstellung fällt das Silber – neben anderen Edelmetallen – im sogenannten [[Wikipedia:Anodenschlamm|Anodenschlamm]] an. Dieser wird zunächst mit [[Wikipedia:Schwefelsäure|Schwefelsäure]] und Luft vom Großteil des noch vorhandenen Kupfers befreit. Anschließend wird er im Ofen oxidierend geschmolzen, wobei enthaltene unedle Metalle in die Schlacke gehen und entfernt werden können. |
| − | === Raffination === | + | ===Raffination=== |
| − | [[Datei:Silver crystal.jpg|mini|Ein reiner Silber-[[Kristall]], [[Elektrolyse|elektrolytisch]] abgeschieden mit deutlich sichtbaren [[Dendrit (Kristallographie)|dendritischen]] Strukturen]] | + | [[Datei:Silver crystal.jpg|mini|Ein reiner Silber-[[Wikipedia:Kristall|Kristall]], [[Wikipedia:Elektrolyse|elektrolytisch]] abgeschieden mit deutlich sichtbaren [[Wikipedia:Dendrit (Kristallographie)|dendritischen]] Strukturen]] |
| − | Rohsilber wird auf [[Elektrolyse|elektrolytischem]] Weg im [[Bernhard Moebius#Moebius-Elektrolyse|Moebius-Verfahren]] gereinigt. Dazu wird das Rohsilber als Anode in eine Elektrolysezelle geschaltet. Als Kathode dient ein Feinsilberblech, als [[Elektrolyt]] salpetersaure [[Silbernitrat]]lösung. | + | Rohsilber wird auf [[Wikipedia:Elektrolyse|elektrolytischem]] Weg im [[Wikipedia:Bernhard Moebius#Moebius-Elektrolyse|Moebius-Verfahren]] gereinigt. Dazu wird das Rohsilber als Anode in eine Elektrolysezelle geschaltet. Als Kathode dient ein Feinsilberblech, als [[Wikipedia:Elektrolyt|Elektrolyt]] salpetersaure [[Wikipedia:Silbernitrat|Silbernitrat]]lösung. |
| − | Das Verfahren entspricht der elektrolytischen Reinigung des Kupfers. Während der Elektrolyse werden Silber und alle unedleren Bestandteile des Rohsilbers (beispielsweise Kupfer oder Blei) [[Oxidation|oxidiert]] und gehen in Lösung. Edlere Anteile wie [[Gold]] und [[Platin]] können nicht oxidiert werden und fallen unter die Elektrode. Dort bilden sie den Anodenschlamm, der eine wichtige Quelle für Gold und andere [[Edelmetalle]] ist. An der Kathode wird nun ausschließlich Silber abgeschieden. Dieses sehr reine Silber bezeichnet man als Elektrolyt- oder Feinsilber.<ref>[http://www.chids.de/dachs/expvortr/683Silber_Hildebrand.doc Anorganischer Experimentalvortrag: Silber S. 9, ''Elektrolytische Feinreinigung (Möbius-Verfahren).''] ([[Microsoft Word|MS Word]]; 1,1 MB).</ref> | + | Das Verfahren entspricht der elektrolytischen Reinigung des Kupfers. Während der Elektrolyse werden Silber und alle unedleren Bestandteile des Rohsilbers (beispielsweise Kupfer oder Blei) [[Wikipedia:Oxidation|oxidiert]] und gehen in Lösung. Edlere Anteile wie [[Gold]] und [[Wikipedia:Platin|Platin]] können nicht oxidiert werden und fallen unter die Elektrode. Dort bilden sie den Anodenschlamm, der eine wichtige Quelle für Gold und andere [[Wikipedia:Edelmetalle|Edelmetalle]] ist. An der Kathode wird nun ausschließlich Silber abgeschieden. Dieses sehr reine Silber bezeichnet man als Elektrolyt- oder Feinsilber.<ref>[http://www.chids.de/dachs/expvortr/683Silber_Hildebrand.doc Anorganischer Experimentalvortrag: Silber S. 9, ''Elektrolytische Feinreinigung (Möbius-Verfahren).''] ([[Wikipedia:Microsoft Word|MS Word]]; 1,1 MB).</ref> |
| − | == Eigenschaften == | + | ==Eigenschaften== |
| − | === Physikalische Eigenschaften === | + | ===Physikalische Eigenschaften=== |
| − | Silber ist ein weißglänzendes [[Edelmetalle|Edelmetall]]. Das Metall kristallisiert im [[Kubisches Kristallsystem|kubischen-flächenzentrierten Kristallsystem]]. Unter Normaldruck betragen die [[Schmelztemperatur]] 961 °C und die [[Siedetemperatur]] 2212 °C. Silber hat aber bereits oberhalb von 700 °C, also noch im festen Zustand, einen deutlichen [[Dampfdruck]]. Es siedet unter Bildung eines einatomigen, blauen Dampfes. Das Edelmetall besitzt eine Dichte von 10,49 g/cm³ (bei 20 °C) und gehört daher wie alle Edelmetalle zu den Schwermetallen. | + | Silber ist ein weißglänzendes [[Wikipedia:Edelmetalle|Edelmetall]]. Das Metall kristallisiert im [[Wikipedia:Kubisches Kristallsystem|kubischen-flächenzentrierten Kristallsystem]]. Unter Normaldruck betragen die [[Wikipedia:Schmelztemperatur|Schmelztemperatur]] 961 °C und die [[Wikipedia:Siedetemperatur|Siedetemperatur]] 2212 °C. Silber hat aber bereits oberhalb von 700 °C, also noch im festen Zustand, einen deutlichen [[Wikipedia:Dampfdruck|Dampfdruck]]. Es siedet unter Bildung eines einatomigen, blauen Dampfes. Das Edelmetall besitzt eine Dichte von 10,49 g/cm³ (bei 20 °C) und gehört daher wie alle Edelmetalle zu den Schwermetallen. |
| − | Silber hat einen metallischen Glanz. Frische, unkorrodierte (Schnitt)flächen von Silber zeigen die höchsten Licht-Reflexionseigenschaften aller Metalle, frisch abgeschiedenes Silber reflektiert über 99,5 % des sichtbaren Lichtes. Als „weißestes“ aller Gebrauchsmetalle wird es daher auch zur Herstellung von Spiegeln<ref>Ludwig Hartmann: ''Faraday an Liebig (1858): Zur Geschichte der Silberspiegelherstellung.'' In: ''Sudhoffs Archiv.'' 32, 1939/40, S. 397–398.</ref> benutzt. [[Strichfarbe]] ist ein gräuliches Weiß. Mit abnehmender Korngröße wird die Farbe immer dunkler und ist bei fotografisch fein verteilten Silberkristallen schwarz. Das [[Reflexion (Physik)|Reflexionsspektrum]] zeigt im nahen [[Ultraviolettstrahlung|UV]] eine ausgeprägte [[Plasmakante]]. | + | Silber hat einen metallischen Glanz. Frische, unkorrodierte (Schnitt)flächen von Silber zeigen die höchsten Licht-Reflexionseigenschaften aller Metalle, frisch abgeschiedenes Silber reflektiert über 99,5 % des sichtbaren Lichtes. Als „weißestes“ aller Gebrauchsmetalle wird es daher auch zur Herstellung von Spiegeln<ref>Ludwig Hartmann: ''Faraday an Liebig (1858): Zur Geschichte der Silberspiegelherstellung.'' In: ''Sudhoffs Archiv.'' 32, 1939/40, S. 397–398.</ref> benutzt. [[Wikipedia:Strichfarbe|Strichfarbe]] ist ein gräuliches Weiß. Mit abnehmender Korngröße wird die Farbe immer dunkler und ist bei fotografisch fein verteilten Silberkristallen schwarz. Das [[Wikipedia:Reflexion (Physik)|Reflexionsspektrum]] zeigt im nahen [[Wikipedia:Ultraviolettstrahlung|UV]] eine ausgeprägte [[Wikipedia:Plasmakante|Plasmakante]]. |
| − | Silber leitet von allen Metallen [[Wärme]] und [[Elektrizität]] am besten. Wegen seiner Dehnbarkeit und Weichheit ([[Mohshärte]] von 2,5–4) lässt es sich zu feinsten, blaugrün durchschimmernden Folien von einer Dicke von nur 0,002 bis 0,003 mm aushämmern oder zu dünnen, bei 2 km Länge nur 0,1 bis 1 g wiegenden Drähten (Filigrandraht) ausziehen. | + | Silber leitet von allen Metallen [[Wärme]] und [[Wikipedia:Elektrizität|Elektrizität]] am besten. Wegen seiner Dehnbarkeit und Weichheit ([[Wikipedia:Mohshärte|Mohshärte]] von 2,5–4) lässt es sich zu feinsten, blaugrün durchschimmernden Folien von einer Dicke von nur 0,002 bis 0,003 mm aushämmern oder zu dünnen, bei 2 km Länge nur 0,1 bis 1 g wiegenden Drähten (Filigrandraht) ausziehen. |
| − | Im geschmolzenen Zustand löst reines Silber leicht aus der Luft das 20-fache Volumen an Sauerstoff, der beim Erstarren der Schmelze unter Aufplatzen der bereits erstarrten Oberfläche ([[Spratzen]]) wieder entweicht. Bereits gering legiertes Silber zeigt diese Eigenschaft nicht. | + | Im geschmolzenen Zustand löst reines Silber leicht aus der Luft das 20-fache Volumen an Sauerstoff, der beim Erstarren der Schmelze unter Aufplatzen der bereits erstarrten Oberfläche ([[Wikipedia:Spratzen|Spratzen]]) wieder entweicht. Bereits gering legiertes Silber zeigt diese Eigenschaft nicht. |
| + | |||
| + | ===Chemische Eigenschaften=== | ||
| + | [[Datei:Eichbaum.jpg|mini|Durch Silbersulfidbelag dunkel angelaufene deutsche Silbermünze von 1927: 5-[[Wikipedia:Reichsmark|Reichsmark]]-[[Wikipedia:Kursmünze|Kursmünze]] „Eichbaum“ (geprägt 1927–1933)]] | ||
| + | Silber ist ein Edelmetall mit einem Normalpotential von +0,7991 V. Aus diesem Grund ist es relativ reaktionsträge. Es reagiert auch bei höherer Temperatur nicht mit dem Sauerstoff der Luft. Da in der Luft spurenweise [[Wikipedia:Schwefelwasserstoff|Schwefelwasserstoff]] H<sub>2</sub>S enthalten ist, laufen Silberoberflächen allerdings mit der Zeit schwarz an, da elementares Silber mit Schwefelwasserstoff in Anwesenheit von Luftsauerstoff [[Wikipedia:Silbersulfid|Silbersulfid]] (Ag<sub>2</sub>S) bildet: | ||
| − | |||
| − | |||
| − | |||
:<math>\mathrm{4\ Ag\ +\ 2 \ H_2S\ +\ O_2 \rightarrow\ 2\ Ag_2S\ +\ 2\ H_2O}</math>. | :<math>\mathrm{4\ Ag\ +\ 2 \ H_2S\ +\ O_2 \rightarrow\ 2\ Ag_2S\ +\ 2\ H_2O}</math>. | ||
| − | Silber löst sich nur in oxidierenden Säuren, wie beispielsweise [[Salpetersäure]]. In nichtoxidierenden Säuren ist es nicht löslich. Auch in Cyanid-Lösungen löst es sich bei Anwesenheit von Sauerstoff durch die Bildung eines sehr stabilen Silbercyanid-Komplexes, wodurch das elektrochemische Potential stark verschoben ist. In konzentrierter [[Schwefelsäure|Schwefel-]] und Salpetersäure löst sich Silber nur bei erhöhten Temperaturen, da es durch [[Silbernitrat]] und [[Silbersulfat|-sulfat]] passiviert ist. Silber ist stabil gegen geschmolzene Alkalihydroxide wie [[Natriumhydroxid]]. Im Labor verwendet man darum für diese Schmelzen auch Silber- anstatt Porzellan- oder Platintiegel. | + | Silber löst sich nur in oxidierenden Säuren, wie beispielsweise [[Wikipedia:Salpetersäure|Salpetersäure]]. In nichtoxidierenden Säuren ist es nicht löslich. Auch in Cyanid-Lösungen löst es sich bei Anwesenheit von Sauerstoff durch die Bildung eines sehr stabilen Silbercyanid-Komplexes, wodurch das elektrochemische Potential stark verschoben ist. In konzentrierter [[Wikipedia:Schwefelsäure|Schwefel-]] und Salpetersäure löst sich Silber nur bei erhöhten Temperaturen, da es durch [[Wikipedia:Silbernitrat|Silbernitrat]] und [[Wikipedia:Silbersulfat|-sulfat]] passiviert ist. Silber ist stabil gegen geschmolzene Alkalihydroxide wie [[Wikipedia:Natriumhydroxid|Natriumhydroxid]]. Im Labor verwendet man darum für diese Schmelzen auch Silber- anstatt Porzellan- oder Platintiegel. |
| − | === Biologisch-medizinische Eigenschaften === | + | ===Biologisch-medizinische Eigenschaften=== |
| − | Silber wirkt in feinstverteilter Form [[bakterizid]], also schwach [[Gift|toxisch]], was aufgrund der großen reaktiven Oberfläche auf die hinreichende Entstehung von löslichen Silberionen zurückzuführen ist. Im lebenden Organismus werden Silberionen jedoch in der Regel schnell an [[Schwefel]] gebunden und scheiden aus dem Stoffkreislauf als dunkles, schwer lösliches [[Silbersulfid]] aus. | + | Silber wirkt in feinstverteilter Form [[Wikipedia:bakterizid|bakterizid]], also schwach [[Wikipedia:Gift|toxisch]], was aufgrund der großen reaktiven Oberfläche auf die hinreichende Entstehung von löslichen Silberionen zurückzuführen ist. Im lebenden Organismus werden Silberionen jedoch in der Regel schnell an [[Schwefel]] gebunden und scheiden aus dem Stoffkreislauf als dunkles, schwer lösliches [[Wikipedia:Silbersulfid|Silbersulfid]] aus. |
| − | Die Wirkung ist oberflächenabhängig. Dies wird in der [[Medizin]] genutzt für [[Wundauflage]]n wie für invasive Geräte (z. B. endotracheale Tuben).<ref name="aerzteblatt-33419">{{Internetquelle |url=http://www.aerzteblatt.de/nachrichten/33419/Mit-Silber-beschichteter-Tubus-senkt-Pneumonierisiko |titel=Mit Silber beschichteter Tubus senkt Pneumonierisiko |werk=[[Deutsches Ärzteblatt|aerzteblatt.de]] |datum=2008-08-20 |zugriff=2014-12-26 | + | Die Wirkung ist oberflächenabhängig. Dies wird in der [[Medizin]] genutzt für [[Wikipedia:Wundauflage|Wundauflage]]n wie für invasive Geräte (z. B. endotracheale Tuben).<ref name="aerzteblatt-33419">{{Internetquelle |url=http://www.aerzteblatt.de/nachrichten/33419/Mit-Silber-beschichteter-Tubus-senkt-Pneumonierisiko |titel=Mit Silber beschichteter Tubus senkt Pneumonierisiko |werk=[[Wikipedia:Deutsches Ärzteblatt|aerzteblatt.de]] |datum=2008-08-20 |zugriff=2014-12-26</ref> In der Regel wird Silber für bakterizide Zwecke daher in [[Wikipedia:Medizinprodukt|Medizinprodukt]]en als Beschichtung oder in kolloidaler Form eingesetzt, zunehmend auch Nanosilber. Silberionen finden als [[Wikipedia:Desinfektionsmittel|Desinfektionsmittel]] und als Therapeutikum in der Wundtherapie Verwendung. Sie können silberempfindliche Erreger nach relativ langer Einwirkzeit reversibel inhibieren, können darüber hinaus bakteriostatisch oder sogar bakterizid (also abtötend) wirken. Man spricht hier vom [[Wikipedia:Oligodynamie|oligodynamischen]] Effekt. In manchen Fällen werden Chlorverbindungen zugesetzt, um die geringe Wirksamkeit des Silbers zu erhöhen. |
| + | |||
| + | Dabei kommen verschiedene Wirkmechanismen zum Einsatz:<ref name="PMID23785037">J. R. Morones-Ramirez, J. A. Winkler u. a.: ''Silver enhances antibiotic activity against gram-negative bacteria.'' In: ''[[Wikipedia:Science Translational Medicine|Science Translational Medicine]].'' Band 5, Nummer 190, Juni 2013, S. 190ra81, [[doi:10.1126/scitranslmed.3006276]]. PMID 23785037.</ref> | ||
| + | |||
| + | *Blockierung von [[Wikipedia:Enzym|Enzym]]en und Unterbindung deren lebensnotwendiger Transportfunktionen in der Zelle, | ||
| + | *Beeinträchtigung der Zellstrukturfestigkeit, | ||
| + | *Schädigung der Membranstruktur. | ||
| − | |||
| − | |||
| − | |||
| − | |||
Die beschriebenen Effekte können zum Zelltod führen. | Die beschriebenen Effekte können zum Zelltod führen. | ||
| − | Neben der [[Argyrie]], einer irreversiblen schiefergrauen Verfärbung von Haut und Schleimhäuten, kann es bei erhöhter Silberakkumulation im Körper außerdem zu [[Geschmacksstörung]]en und [[Riechstörung]]en sowie [[Gehirn|zerebralen]] [[Krampf]]anfällen kommen. Silber reichert sich in der Haut, der [[Leber]], den [[Niere]]n, der [[Hornhaut]] der Augen, im [[Zahnfleisch]], in [[Schleimhaut|Schleimhäuten]], [[Nagel (Anatomie)|Nägeln]] und der [[Milz]] an.<ref>M. Glehr, A. Leithner, J. Friesenbichler, W. Goessler, A. Avian, D. Andreou, W. Maurer-Ertl, R. Windhager, P.-U. Tunn: ''Argyria following the use of silver-coated megaprostheses.'' In: ''[[The Bone and Joint Journal]].'' Band 95-B, Ausgabe 7, Juli 2013, S. 988–992.</ref> | + | Neben der [[Wikipedia:Argyrie|Argyrie]], einer irreversiblen schiefergrauen Verfärbung von Haut und Schleimhäuten, kann es bei erhöhter Silberakkumulation im Körper außerdem zu [[Wikipedia:Geschmacksstörung|Geschmacksstörung]]en und [[Wikipedia:Riechstörung|Riechstörung]]en sowie [[Gehirn|zerebralen]] [[Wikipedia:Krampf|Krampf]]anfällen kommen. Silber reichert sich in der Haut, der [[Leber]], den [[Wikipedia:Niere|Niere]]n, der [[Wikipedia:Hornhaut|Hornhaut]] der Augen, im [[Wikipedia:Zahnfleisch|Zahnfleisch]], in [[Wikipedia:Schleimhaut|Schleimhäuten]], [[Wikipedia:Nagel (Anatomie)|Nägeln]] und der [[Milz]] an.<ref>M. Glehr, A. Leithner, J. Friesenbichler, W. Goessler, A. Avian, D. Andreou, W. Maurer-Ertl, R. Windhager, P.-U. Tunn: ''Argyria following the use of silver-coated megaprostheses.'' In: ''[[The Bone and Joint Journal]].'' Band 95-B, Ausgabe 7, Juli 2013, S. 988–992.</ref> |
| − | Umstritten ist die therapeutische Einnahme von [[Kolloidales Silber|kolloidalem Silber]], das seit einigen Jahren wieder verstärkt ins Blickfeld der Öffentlichkeit rückt und über Internet und andere Kanäle vermarktet wird. Es wird vor allem als Universal[[antibiotikum]] angepriesen und soll noch andere Leiden kurieren können. Wissenschaftliche Studien über die Wirksamkeit gibt es nicht. Bereits die mit einem gängigen Antibiotikum vergleichbare Wirkung ist bei [[peroral]]er Verabreichung stark anzuzweifeln. Sehr geringe oral aufgenommene Mengen bis 5 Mikrogramm Silber pro Kilogramm Körpergewicht und Tag sollen nach Ansicht der amerikanischen Umweltschutzbehörde EPA zu keiner Vergiftung führen.<ref>[http://www.epa.gov/iris/subst/0099.htm#oralrfd ''Silver (CASRN 7440-22-4).''] auf der Webseite der amerikanischen Umweltschutzbehörde EPA.</ref> | + | Umstritten ist die therapeutische Einnahme von [[Wikipedia:Kolloidales Silber|kolloidalem Silber]], das seit einigen Jahren wieder verstärkt ins Blickfeld der Öffentlichkeit rückt und über Internet und andere Kanäle vermarktet wird. Es wird vor allem als Universal[[Wikipedia:antibiotikum|antibiotikum]] angepriesen und soll noch andere Leiden kurieren können. Wissenschaftliche Studien über die Wirksamkeit gibt es nicht. Bereits die mit einem gängigen Antibiotikum vergleichbare Wirkung ist bei [[Wikipedia:peroral|peroral]]er Verabreichung stark anzuzweifeln. Sehr geringe oral aufgenommene Mengen bis 5 Mikrogramm Silber pro Kilogramm Körpergewicht und Tag sollen nach Ansicht der amerikanischen Umweltschutzbehörde EPA zu keiner Vergiftung führen.<ref>[http://www.epa.gov/iris/subst/0099.htm#oralrfd ''Silver (CASRN 7440-22-4).''] auf der Webseite der amerikanischen Umweltschutzbehörde EPA.</ref> |
| − | Silber wurde 2014 von der EU gemäß der [[Verordnung (EG) Nr. 1907/2006]] (REACH) im Rahmen der [[Stoffbewertung]] in den fortlaufenden Aktionsplan der Gemeinschaft ([[CoRAP]]) aufgenommen. Hierbei werden die Auswirkungen des [[Chemischer Stoff#Definitionen des Gesetzgebers|Stoffs]] auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Silber waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung. Die Neubewertung fand ab 2014 statt und wurde von den [[Niederlande]]n durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.<ref>[[Europäische Chemikalienagentur]] (ECHA): [https://echa.europa.eu/documents/10162/c6597a4b-a88f-9bc9-1a23-b8a41772302c ''Substance Evaluation Conclusion and Evaluation Report''].</ref><ref>{{CoRAP-Status |ID=100.028.301 |Name=Silver |Evaluationsjahr=2014 |Status=Concluded |Datum=20. Mai 2019}}</ref> | + | Silber wurde 2014 von der EU gemäß der [[Wikipedia:Verordnung (EG) Nr. 1907/2006|Verordnung (EG) Nr. 1907/2006]] (REACH) im Rahmen der [[Wikipedia:Stoffbewertung|Stoffbewertung]] in den fortlaufenden Aktionsplan der Gemeinschaft ([[Wikipedia:CoRAP|CoRAP]]) aufgenommen. Hierbei werden die Auswirkungen des [[Wikipedia:Chemischer Stoff#Definitionen des Gesetzgebers|Stoffs]] auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Silber waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung. Die Neubewertung fand ab 2014 statt und wurde von den [[Wikipedia:Niederlande|Niederlande]]n durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.<ref>[[Wikipedia:Europäische Chemikalienagentur|Europäische Chemikalienagentur]] (ECHA): [https://echa.europa.eu/documents/10162/c6597a4b-a88f-9bc9-1a23-b8a41772302c ''Substance Evaluation Conclusion and Evaluation Report''].</ref><ref>{{CoRAP-Status |ID=100.028.301 |Name=Silver |Evaluationsjahr=2014 |Status=Concluded |Datum=20. Mai 2019}}</ref> |
| − | === Mythologische Eigenschaften === | + | ===Mythologische Eigenschaften=== |
| − | Silber gilt in vielen [[Märchen]] und [[Sage]]n als das einzige Metall, das in der Lage ist, [[Werwölfe]] und andere mythologische Wesen zu töten, was auch in modernen [[Fantasy]]-Romanen und Filmen häufig aufgegriffen wird.<ref>Robert Jackson: ''Witchcraft and the Occult.'' Quintet Publishing, Devizes 1995, S. 25.</ref> | + | Silber gilt in vielen [[Wikipedia:Märchen|Märchen]] und [[Wikipedia:Sage|Sage]]n als das einzige Metall, das in der Lage ist, [[Wikipedia:Werwölfe|Werwölfe]] und andere mythologische Wesen zu töten, was auch in modernen [[Wikipedia:Fantasy|Fantasy]]-Romanen und Filmen häufig aufgegriffen wird.<ref>Robert Jackson: ''Witchcraft and the Occult.'' Quintet Publishing, Devizes 1995, S. 25.</ref> |
| − | == Verwendung == | + | ==Verwendung== |
[[Datei:Silver Bar 01.jpg|mini|5-kg-Silberbarren]] | [[Datei:Silver Bar 01.jpg|mini|5-kg-Silberbarren]] | ||
| − | === Silberpreis === | + | ===Silberpreis=== |
{{Hauptartikel|Silberpreis}} | {{Hauptartikel|Silberpreis}} | ||
| − | Der Preis des Silbers wird auf dem offenen Markt bestimmt. Das geschieht seit dem 17. Jahrhundert am [[London Bullion Market]]. Die Einführung des [[Silberfixing]]s 1897 in London markiert den Beginn der Marktstruktur. 1987 wurde die London Bullion Market Association (LBMA) gegründet. Drei LBMA-Mitglieder nehmen am Silberfixing an jedem Arbeitstag unter Vorsitz der [[Scotiabank|Bank of Nova Scotia - ScotiaMocatta]] teil. Weitere Mitglieder des Silberfixings sind die [[Deutsche Bank]] AG London und [[HSBC]] Bank USA NA London Branch. | + | Der Preis des Silbers wird auf dem offenen Markt bestimmt. Das geschieht seit dem 17. Jahrhundert am [[Wikipedia:London Bullion Market|London Bullion Market]]. Die Einführung des [[Silberfixing]]s 1897 in London markiert den Beginn der Marktstruktur. 1987 wurde die London Bullion Market Association (LBMA) gegründet. Drei LBMA-Mitglieder nehmen am Silberfixing an jedem Arbeitstag unter Vorsitz der [[Wikipedia:Scotiabank|Bank of Nova Scotia - ScotiaMocatta]] teil. Weitere Mitglieder des Silberfixings sind die [[Wikipedia:Deutsche Bank|Deutsche Bank]] AG London und [[Wikipedia:HSBC|HSBC]] Bank USA NA London Branch. |
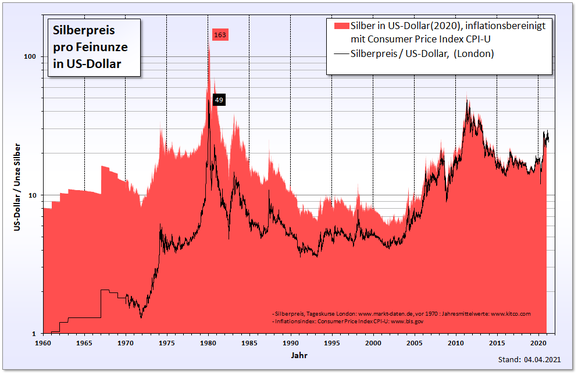
| − | In den 1970er Jahren führte die [[Silberspekulation]] der [[Nelson Bunker Hunt|Brüder Hunt]] zu einem Rekordstand beim [[Silberpreis]]. Diese kauften im Zusammenspiel mit vermögenden Geschäftsleuten aus [[Saudi-Arabien]] riesige Mengen an Silber sowie Silberkontrakten an den [[Warenterminbörse]]n und versuchten, den Silbermarkt zu beherrschen.<ref name="faz-1294334">{{Internetquelle |url=http://www.faz.net/aktuell/finanzen/fonds-mehr/historische-finanzkrisen-die-silberkrise-von-1980-regelaenderung-mitten-im-spiel-1294334.html |titel=Regeländerung mitten im Spiel |autor=Steffen Uttich |werk=[[Frankfurter Allgemeine Zeitung#FAZ.NET|FAZ.net]] |datum=2008-07-05 |zugriff=2014-12-26}}</ref> Am 18. Januar 1980 wurde beim Silberfixing am London Bullion Market ein Rekordstand von 49,45 US-Dollar pro [[Feinunze]] ermittelt. Den nächsten Rekord erreichte der Silberpreis erst über 31 Jahre später, am 25. April 2011, als die Feinunze Silber in Hong Kong mit 49,80 US-Dollar gehandelt wurde.<ref>[http://www.diesilberseite.com/ Übersicht der Tagesentwicklung zum Rekordkurs, April bis Mai 2011].</ref> Dem Inflationsrechner des [[United States Department of Labor]] zufolge entsprechen 49,45 US-Dollar von 1980 im Jahr 2011 einer Summe von 134,99 US-Dollar.<ref>[http://www.bls.gov/data/inflation_calculator.htm Inflation Calculator].</ref> Daher dürfte es noch lange dauern bis der Preis von 1980 unter Berücksichtigung der Inflation überschritten wird. | + | In den 1970er Jahren führte die [[Wikipedia:Silberspekulation|Silberspekulation]] der [[Wikipedia:Nelson Bunker Hunt|Brüder Hunt]] zu einem Rekordstand beim [[Wikipedia:Silberpreis|Silberpreis]]. Diese kauften im Zusammenspiel mit vermögenden Geschäftsleuten aus [[Wikipedia:Saudi-Arabien|Saudi-Arabien]] riesige Mengen an Silber sowie Silberkontrakten an den [[Wikipedia:Warenterminbörse|Warenterminbörse]]n und versuchten, den Silbermarkt zu beherrschen.<ref name="faz-1294334">{{Internetquelle |url=http://www.faz.net/aktuell/finanzen/fonds-mehr/historische-finanzkrisen-die-silberkrise-von-1980-regelaenderung-mitten-im-spiel-1294334.html |titel=Regeländerung mitten im Spiel |autor=Steffen Uttich |werk=[[Wikipedia:Frankfurter Allgemeine Zeitung#FAZ.NET|FAZ.net]] |datum=2008-07-05 |zugriff=2014-12-26}}</ref> Am 18. Januar 1980 wurde beim Silberfixing am London Bullion Market ein Rekordstand von 49,45 US-Dollar pro [[Wikipedia:Feinunze|Feinunze]] ermittelt. Den nächsten Rekord erreichte der Silberpreis erst über 31 Jahre später, am 25. April 2011, als die Feinunze Silber in Hong Kong mit 49,80 US-Dollar gehandelt wurde.<ref>[http://www.diesilberseite.com/ Übersicht der Tagesentwicklung zum Rekordkurs, April bis Mai 2011].</ref> Dem Inflationsrechner des [[Wikipedia:United States Department of Labor|United States Department of Labor]] zufolge entsprechen 49,45 US-Dollar von 1980 im Jahr 2011 einer Summe von 134,99 US-Dollar.<ref>[http://www.bls.gov/data/inflation_calculator.htm Inflation Calculator].</ref> Daher dürfte es noch lange dauern bis der Preis von 1980 unter Berücksichtigung der Inflation überschritten wird. |
| − | Für den standardisierten Silberhandel an [[Rohstoffbörse]]n wurde „[[XAG]]“ als eigenes Währungskürzel nach [[ISO 4217]] vergeben. Es bezeichnet den Preis einer Feinunze Silber (31,1 Gramm). | + | Für den standardisierten Silberhandel an [[Wikipedia:Rohstoffbörse|Rohstoffbörse]]n wurde „[[Wikipedia:XAG|XAG]]“ als eigenes Währungskürzel nach [[Wikipedia:ISO 4217|ISO 4217]] vergeben. Es bezeichnet den Preis einer Feinunze Silber (31,1 Gramm). |
<gallery heights="250" mode="packed" style="text-align:left;"> | <gallery heights="250" mode="packed" style="text-align:left;"> | ||
| − | Silberpreis in Dollar ab 1792.png|Silberpreis ab 1792 (in US-Dollar) | + | Datei:Silberpreis in Dollar ab 1792.png|Silberpreis ab 1792 (in US-Dollar) |
| − | Silberpreis in Dollar.png|Silberpreis ab 1960, nominal und inflationsbereinigt (in US-Dollar) | + | Datei:Silberpreis in Dollar.png|Silberpreis ab 1960, nominal und inflationsbereinigt (in US-Dollar) |
</gallery> | </gallery> | ||
| − | === Währung und Wertanlage === | + | ===Währung und Wertanlage=== |
| − | [[Datei:Silberschatz Pompeji retouched.jpg|mini|Silberschatz aus [[Pompeji]], [[Italien]], 79 n. Chr. Vorne, von links: [[Patera (Gefäß)|Patera]] (römische Opferschale), Schöpflöffel für Wein ([[Simpulum]]), Patera, Spiegel. Im Hintergrund zwei Krüge und Schalen.]] | + | [[Datei:Silberschatz Pompeji retouched.jpg|mini|Silberschatz aus [[Wikipedia:Pompeji|Pompeji]], [[Wikipedia:Italien|Italien]], 79 n. Chr. Vorne, von links: [[Wikipedia:Patera (Gefäß)|Patera]] (römische Opferschale), Schöpflöffel für Wein ([[Wikipedia:Simpulum|Simpulum]]), Patera, Spiegel. Im Hintergrund zwei Krüge und Schalen.]] |
| − | [[Datei:Silberspiegel, Fundstück aus Pompeji retouched.jpg|mini|[[Spiegel]] aus massivem Silber, Fundstück aus [[Pompeji]], [[Italien]], 79 n. Chr.]] | + | [[Datei:Silberspiegel, Fundstück aus Pompeji retouched.jpg|mini|[[Wikipedia:Spiegel|Spiegel]] aus massivem Silber, Fundstück aus [[Wikipedia:Pompeji|Pompeji]], [[Wikipedia:Italien|Italien]], 79 n. Chr.]] |
| − | Die früher wichtigste Verwendung war die Herstellung von [[Silbermünze]]n als Zahlungsmittel. Für [[Münze]]n wurde in der Antike und im Mittelalter nur Silber, [[Gold]] und [[Kupfer]] bzw. [[Bronze]] verwendet. Der Münzwert entsprach weitgehend dem Metallwert ([[Kurantmünze]]). In [[Deutschland]] waren bis 1871 Silbermünzen ([[Taler]]) vorherrschend, die [[Währung]] war durch Silber [[Währungsdeckung|gedeckt]] ([[Silberstandard]]). Nach 1871 wurde der Silber- durch den [[Goldstandard]] abgelöst. Der Grund für die Verwendung dieser Edelmetalle waren die hohe Wertspeicherung (Seltenheit) und Wertbeständigkeit von Silber und Gold. Erst in moderner Zeit werden Münzen auch aus anderen Metallen, wie Eisen, Nickel oder Zink hergestellt, deren Metallwert aber geringer ist und nicht dem aufgeprägten Wert entspricht ([[Scheidemünze]]). Silber wird als Münzmetall heute meist nur noch für [[Anlagemünze|Anlage-]], [[Gedenkmünze|Gedenk-]] und Sondermünzen verwendet. | + | Die früher wichtigste Verwendung war die Herstellung von [[Wikipedia:Silbermünze|Silbermünze]]n als Zahlungsmittel. Für [[Wikipedia:Münze|Münze]]n wurde in der Antike und im Mittelalter nur Silber, [[Gold]] und [[Kupfer]] bzw. [[Wikipedia:Bronze|Bronze]] verwendet. Der Münzwert entsprach weitgehend dem Metallwert ([[Wikipedia:Kurantmünze|Kurantmünze]]). In [[Wikipedia:Deutschland|Deutschland]] waren bis 1871 Silbermünzen ([[Wikipedia:Taler|Taler]]) vorherrschend, die [[Wikipedia:Währung|Währung]] war durch Silber [[Wikipedia:Währungsdeckung|gedeckt]] ([[Wikipedia:Silberstandard|Silberstandard]]). Nach 1871 wurde der Silber- durch den [[Wikipedia:Goldstandard|Goldstandard]] abgelöst. Der Grund für die Verwendung dieser Edelmetalle waren die hohe Wertspeicherung (Seltenheit) und Wertbeständigkeit von Silber und Gold. Erst in moderner Zeit werden Münzen auch aus anderen Metallen, wie Eisen, Nickel oder Zink hergestellt, deren Metallwert aber geringer ist und nicht dem aufgeprägten Wert entspricht ([[Wikipedia:Scheidemünze|Scheidemünze]]). Silber wird als Münzmetall heute meist nur noch für [[Wikipedia:Anlagemünze|Anlage-]], [[Wikipedia:Gedenkmünze|Gedenk-]] und Sondermünzen verwendet. |
| − | Besonders in Zeiten von [[Wirtschaftskrise]]n – wie z. B. ab 2007 – hat sich neben Gold auch das [[Edelmetalle|Edelmetall]] Silber durch seine Kurs- und Wertstabilität als eine der wichtigsten Anlageform in verschiedensten Ausprägungen wie z. B. Silberbarren, Silberschmuck oder Silbermünzen erwiesen.<ref name="welt-4840200">{{Internetquelle |url=https://www.welt.de/welt_print/finanzen/article4840200/Silber-Rallye-im-Windschatten-des-Goldes.html |titel=Silber-Rallye im Windschatten des Goldes |autor=Michael Höfling |werk=[[Die Welt#Online-Ausgabe|welt.de]] |datum=2009-10-14 |zugriff=2014-12-26}}</ref> Im Umfeld von Währungskrisen gab es seit der Antike mehrmals in der Geschichte ein Silberverbot (s. [[Goldverbot]]). | + | Besonders in Zeiten von [[Wikipedia:Wirtschaftskrise|Wirtschaftskrise]]n – wie z. B. ab 2007 – hat sich neben Gold auch das [[Wikipedia:Edelmetalle|Edelmetall]] Silber durch seine Kurs- und Wertstabilität als eine der wichtigsten Anlageform in verschiedensten Ausprägungen wie z. B. Silberbarren, Silberschmuck oder Silbermünzen erwiesen.<ref name="welt-4840200">{{Internetquelle |url=https://www.welt.de/welt_print/finanzen/article4840200/Silber-Rallye-im-Windschatten-des-Goldes.html |titel=Silber-Rallye im Windschatten des Goldes |autor=Michael Höfling |werk=[[Wikipedia:Die Welt#Online-Ausgabe|welt.de]] |datum=2009-10-14 |zugriff=2014-12-26}}</ref> Im Umfeld von Währungskrisen gab es seit der Antike mehrmals in der Geschichte ein Silberverbot (s. [[Wikipedia:Goldverbot|Goldverbot]]). |
| − | === Wirtschaft und Sport === | + | ===Wirtschaft und Sport=== |
| − | Silber ist neben Gold und [[Schmuckstein|Edelsteinen]] (z. B. [[Diamant]]en) ein wichtiges Material für die Herstellung von [[Schmuck]] und wird seit Jahrhunderten für erlesenes und wertbeständiges [[Essbesteck]] (''[[Tafelsilber]]'') und [[Sakrales Gerät]] verwendet. [[Silberstempel]] (Meistermarke, Stadtmarke, Steuermarke u. a. Punzen) geben Auskunft über die Herkunft des Gegenstandes. Bei Schmuck, Gerät und Barren kann der Silbergehalt, sofern angegeben, anhand des [[Feingehaltstempel]]s abgelesen werden. | + | Silber ist neben Gold und [[Wikipedia:Schmuckstein|Edelsteinen]] (z. B. [[Wikipedia:Diamant|Diamant]]en) ein wichtiges Material für die Herstellung von [[Wikipedia:Schmuck|Schmuck]] und wird seit Jahrhunderten für erlesenes und wertbeständiges [[Wikipedia:Essbesteck|Essbesteck]] (''[[Wikipedia:Tafelsilber|Tafelsilber]]'') und [[Wikipedia:Sakrales Gerät|Sakrales Gerät]] verwendet. [[Wikipedia:Silberstempel|Silberstempel]] (Meistermarke, Stadtmarke, Steuermarke u. a. Punzen) geben Auskunft über die Herkunft des Gegenstandes. Bei Schmuck, Gerät und Barren kann der Silbergehalt, sofern angegeben, anhand des [[Wikipedia:Feingehaltstempel|Feingehaltstempel]]s abgelesen werden. |
| − | [[Silbermedaille]]n werden bei vielen Sportwettkämpfen, z. B. bei den [[Olympische Spiele|Olympischen Spielen]], als Zeichen für das Erreichen des zweiten Platzes verliehen. Die olympische [[Goldmedaille]] besteht ebenfalls zu 92,5 % aus Silber und ist lediglich mit 6 g reinem Gold vergoldet. Auch in anderen Bereichen werden Auszeichnungen häufig als „silbern“ bezeichnet. Beispiele sind [[Silberner Bär]], [[Zilveren Griffel|Silberner Griffel]], [[Silberner Schuh]] und [[Silbernes Lorbeerblatt]]. | + | [[Wikipedia:Silbermedaille|Silbermedaille]]n werden bei vielen Sportwettkämpfen, z. B. bei den [[Wikipedia:Olympische Spiele|Olympischen Spielen]], als Zeichen für das Erreichen des zweiten Platzes verliehen. Die olympische [[Wikipedia:Goldmedaille|Goldmedaille]] besteht ebenfalls zu 92,5 % aus Silber und ist lediglich mit 6 g reinem Gold vergoldet. Auch in anderen Bereichen werden Auszeichnungen häufig als „silbern“ bezeichnet. Beispiele sind [[Wikipedia:Silberner Bär|Silberner Bär]], [[Wikipedia:Zilveren Griffel|Silberner Griffel]], [[Wikipedia:Silberner Schuh|Silberner Schuh]] und [[Wikipedia:Silbernes Lorbeerblatt|Silbernes Lorbeerblatt]]. |
| − | Sehr begehrt ist es auch bei [[Musikinstrument]]en, da es aufgrund seiner Dichte einen schönen, warmen Ton von sich gibt, leicht zu verarbeiten ist und z. B. bei der [[Querflöte]] das empfindliche [[Holz]] ersetzt. | + | Sehr begehrt ist es auch bei [[Wikipedia:Musikinstrument|Musikinstrument]]en, da es aufgrund seiner Dichte einen schönen, warmen Ton von sich gibt, leicht zu verarbeiten ist und z. B. bei der [[Wikipedia:Querflöte|Querflöte]] das empfindliche [[Holz]] ersetzt. |
| − | Silber besitzt die höchste [[elektrische Leitfähigkeit]] aller Metalle, eine hohe [[Wärmeleitfähigkeit]] und eine ausgeprägte optische [[Reflexion (Physik)|Reflexionsfähigkeit]]. Dadurch ist es für Anwendungen in [[Elektrik]], [[Elektronik]] und [[Optik]] prädestiniert. Die Reflexionsfähigkeit von Glasspiegeln beruht auf der chemischen [[Versilberung]] von Glasscheiben. Dieses Prinzip wird auch bei der Fertigung von Christbaumschmuck, Optiken und Licht- oder Wärmereflektoren verwendet. Eine [[Suspension (Chemie)|Suspension]] von Silberpulver in [[Klebstoff]]en macht sie zu elektrisch (und thermisch) leitfähigen Klebern. | + | Silber besitzt die höchste [[Wikipedia:elektrische Leitfähigkeit|elektrische Leitfähigkeit]] aller Metalle, eine hohe [[Wikipedia:Wärmeleitfähigkeit|Wärmeleitfähigkeit]] und eine ausgeprägte optische [[Wikipedia:Reflexion (Physik)|Reflexionsfähigkeit]]. Dadurch ist es für Anwendungen in [[Wikipedia:Elektrik|Elektrik]], [[Wikipedia:Elektronik|Elektronik]] und [[Wikipedia:Optik|Optik]] prädestiniert. Die Reflexionsfähigkeit von Glasspiegeln beruht auf der chemischen [[Wikipedia:Versilberung|Versilberung]] von Glasscheiben. Dieses Prinzip wird auch bei der Fertigung von Christbaumschmuck, Optiken und Licht- oder Wärmereflektoren verwendet. Eine [[Wikipedia:Suspension (Chemie)|Suspension]] von Silberpulver in [[Wikipedia:Klebstoff|Klebstoff]]en macht sie zu elektrisch (und thermisch) leitfähigen Klebern. |
| − | Die Schwärzung der [[Silberhalogenid]]e infolge ihres Zerfalls durch Licht und Entwicklung wird beim [[Fotopapier]] genutzt. Es bildete von etwa 1850 bis zur Verbreitung der [[Geschichte und Entwicklung der Fotografie#Digitalfotografie|Digitaltechnik]] die Grundlage der [[Fotografie]]. | + | Die Schwärzung der [[Wikipedia:Silberhalogenid|Silberhalogenid]]e infolge ihres Zerfalls durch Licht und Entwicklung wird beim [[Wikipedia:Fotopapier|Fotopapier]] genutzt. Es bildete von etwa 1850 bis zur Verbreitung der [[Wikipedia:Geschichte und Entwicklung der Fotografie#Digitalfotografie|Digitaltechnik]] die Grundlage der [[Wikipedia:Fotografie|Fotografie]]. |
| − | Silber[[legierung]]en (mit [[Kupfer]], [[Zink]], [[Zinn]], [[Nickel]], [[Indium]] usw.) werden in der [[Elektrotechnik]] und [[Löten|Löttechnik]] als Lotlegierungen (sogenanntes [[Lot (Metall)|Hartlöten]]), Kontaktmaterialien (z. B. in Relais) und Leitmaterial (z. B. als Kondensatorbeläge) verwendet. Silberlegierungen werden aber auch in der [[Dentaltechnik]] und im dekorativen Bereich verwendet. | + | Silber[[Wikipedia:legierung|legierung]]en (mit [[Kupfer]], [[Zink]], [[Zinn]], [[Wikipedia:Nickel|Nickel]], [[Wikipedia:Indium|Indium]] usw.) werden in der [[Wikipedia:Elektrotechnik|Elektrotechnik]] und [[Wikipedia:Löten|Löttechnik]] als Lotlegierungen (sogenanntes [[Wikipedia:Lot (Metall)|Hartlöten]]), Kontaktmaterialien (z. B. in Relais) und Leitmaterial (z. B. als Kondensatorbeläge) verwendet. Silberlegierungen werden aber auch in der [[Wikipedia:Dentaltechnik|Dentaltechnik]] und im dekorativen Bereich verwendet. |
| − | Silbergeschirre und -geräte geben beim Gebrauch immer etwas Silber an die Speisen und Getränke ab, was sich besonders bei manchen Getränken (Wein) in einem unangenehmen Metallgeschmack bemerkbar machen kann. Um dies zu vermeiden, werden silberne Trinkgefäße oft innen vergoldet. Durch [[Silbersulfid]] angelaufenes Silber wird entweder poliert oder chemisch [[Reduktion (Chemie)|reduziert]] (siehe [[Silberpflege]]). | + | Silbergeschirre und -geräte geben beim Gebrauch immer etwas Silber an die Speisen und Getränke ab, was sich besonders bei manchen Getränken (Wein) in einem unangenehmen Metallgeschmack bemerkbar machen kann. Um dies zu vermeiden, werden silberne Trinkgefäße oft innen vergoldet. Durch [[Wikipedia:Silbersulfid|Silbersulfid]] angelaufenes Silber wird entweder poliert oder chemisch [[Wikipedia:Reduktion (Chemie)|reduziert]] (siehe [[Wikipedia:Silberpflege|Silberpflege]]). |
| − | === Silber in medizinischen und medizinnahen Anwendungen === | + | ===Silber in medizinischen und medizinnahen Anwendungen=== |
| − | Werkstoffe oder Beschichtungsverfahren nutzen die antibakterielle Wirkung von Silber in Medizinprodukten und anderen Anwendungen in Form von Silberbeschichtungen, als [[kolloidales Silber]], Nanosilber oder in Form von Silberfäden. | + | Werkstoffe oder Beschichtungsverfahren nutzen die antibakterielle Wirkung von Silber in Medizinprodukten und anderen Anwendungen in Form von Silberbeschichtungen, als [[Wikipedia:kolloidales Silber|kolloidales Silber]], Nanosilber oder in Form von Silberfäden. |
Beispiele in Medizinprodukten: | Beispiele in Medizinprodukten: | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | *Wundauflagen mit kolloidalem Silber oder Nanosilber | |
| − | * | + | *Silberbeschichtungen endoskopischer Tuben |
| − | * | + | *Silberbeschichtung von [[Wikipedia:Endoprothese|Endoprothese]]n |
| − | + | *Kunststoffe mit Silberdotierung zur Anwendung in der Medizintechnik | |
| − | + | *Silberhaltige Cremes als Arzneimittel und Kosmetika, z. B. bei Schuppen mit Hautpilzverdacht oder bei [[Neurodermitis]] | |
| − | + | *Silberplatte als Knochenersatz, typischerweise Schädelknochen, etwa bei [[Wikipedia:Lex Barker|Lex Barker]] nach schwerer Kopfverletzung 1944.<ref>[http://www.lexbarker.net/ Inoffizielle Fanpage von Lex Barker – Biographie] (abgerufen 31. Januar 2012).</ref> In [[Wikipedia:Münchhausens Reise nach Rußland und St. Petersburg|Münchhausens Reise nach Rußland und St. Petersburg]] (ab 1739) wird 1786 über einen trinkfesten General fabuliert, der ''"zugleich mit seinem Hute eine an demselben befestigte silberne Platte aufhob, die ihm statt des Hirnschädels diente."'' | |
| − | + | ===Beispiele für Hygiene- und andere Anwendungen=== | |
| − | + | *Silberfäden oder Silberionen hemmen in der [[Wikipedia:Antimikrobielle Ausrüstung|antimikrobiellen Ausrüstung]] von Textilien das Wachstum von Bakterien auf der Haut und verhindern damit unangenehme Gerüche. | |
| − | + | *Beschichtung von Oberflächen, z. B. in Kühlschränken, auf Küchenmöbeln, Lichtschaltern und anderen Gegenständen | |
| + | *Antibakterielle [[Wikipedia:Email|Email]]lierungen und [[Wikipedia:Keramik|Keramik]]en | ||
| + | *Silberbeschichtete Wasserfilterkartuschen | ||
| + | *Beläge von [[Wikipedia:Keramikkondensator|keramischen Kondensatoren]] für die Elektrotechnik/Elektronik | ||
| − | + | In Bezug auf die nichtmedizinische Anwendung von Silber empfiehlt das [[Wikipedia:Bundesinstitut für Risikobewertung|Bundesinstitut für Risikobewertung]] (BfR) vorerst generell auf den Einsatz von nanoskaligem Silber oder nanoskaligen Silberverbindungen in verbrauchernahen Produkten zu verzichten.<ref>[http://www.bfr.bund.de/cm/343/bfr_raet_von_nanosilber_in_lebensmitteln_und_produkten_des_taeglichen_bedarfs_ab.pdf BfR rät von Nanosilber in Lebensmitteln und Produkten des täglichen Bedarfs ab], Stellungnahme von 2009 (pdf-Datei, 84 kB), abgerufen am 14. Februar 2012.</ref> | |
| − | === | + | ===Silber in der Katalyse=== |
| − | + | Silberkatalysatoren finden industrielle Anwendung in der Partialoxidation von Ethen zu Ethylenoxid bzw. von Methanol zu Formaldehyd.<ref name="Sachtler1974">P. A. Kilty, W. M. H. Sachtler: ''The Mechanism of the Selective Oxidation of Ethylene to Ethylene Oxide.'' In: ''[[Catalysis Reviews]].'' 10, 1974, S. 1–16; [[doi:10.1080/01614947408079624]]</ref><ref name="Sperber1969">H. Sperber: ''Herstellung von Formaldehyd aus Methanol in der BASF.'' In: ''[[Wikipedia:Chemie Ingenieur Technik|Chemie Ingenieur Technik]].'' 41, 1969, S. 962–966; [[doi:10.1002/cite.330411705]].</ref> Durch die Bedeutung des Silbers für die Oxidationskatalyse sind zahlreiche Untersuchungen zur Wechselwirkung von Silberoberflächen mit Sauerstoff durchgeführt worden. Verschiedene Sauerstoffspezies sind an der Silberoberfläche, im oberflächennahen Bereich und im Silbervolumen lokalisiert. Neben Spezies, die auf das Substrat übertragen werden und mehr oder weniger selektiv zur Oxidation eines Moleküls führen, sind auch Zentren vorhanden, die eine katalytische Dehydrierung ermöglichen. Dies ist interessant im Zusammenhang mit der Tatsache, dass die Partialoxidation von Methanol zu Formaldehyd unterstöchiometrische Mengen an Sauerstoff erfordert.<ref name="Schlögl1998">A. Nagy, G. Mestl, T. Rühle, G. Weinberg, R. Schlögl: ''The Dynamic Restructuring of Electrolytic Silver during the Formaldehyde Synthesis Reaction.'' In: ''[[Wikipedia:Journal of Catalysis|Journal of Catalysis]].'' 179, 1998, S. 548–559; [[doi:10.1006/jcat.1998.2240]].</ref> Die Bildung der Sauerstoffspezies ist abhängig von der Temperatur, aber auch von der Art der Reaktionsatmosphäre. Bestimmte O-Spezies sind ''ex situ'' nicht nachweisbar und stellen hohe Anforderungen an die eingesetzten Charakterisierungsmethoden.<ref name="Schlögl2006">V. I. Bukhtiyarov, A. I. Nizovskii, H. Bluhm, M. Hävecker, E. Kleimenov, A. Knop Gericke, R. Schlögl: ''Combined in situ XPS and PTRMS study of ethylene epoxidation over silver.'' In: ''Journal of Catalysis.'' 238, 2006, S. 260–269; [[doi:10.1016/j.jcat.2005.11.043]].</ref><ref name="Schlögl2009">A. Knop-Gericke, E. Kleimenov, M. Hävecker, R. Blume, D. Teschner, S. Zafeiratos, R. Schlögl, V. I. Bukhtiyarov, V. V. Kaichev, I. P. Prosvirin, A. I. Nizovskii, H. Bluhm, A. Barinov, P. Dudin, M. Kiskinova: ''Chapter 4 X-Ray Photoelectron Spectroscopy for Investigation of Heterogeneous Catalytic Processes.'' In: ''[[Advances in Catalysis]].'' 52, 2009, S. 213–272; [[doi:10.1016/S0360-0564(08)00004-7]].</ref> | |
| − | == Silberlegierungen == | + | Silber katalysiert anderseits auch die Reduktion organischer Substrate durch Wasserstoff, z. B. die Hydrierung von α,β-ungesättigten Carbonylverbindungen. Die Wechselwirkung von H<sub>2</sub> mit Silberkatalysatoren ist – verglichen mit klassischen [[Wikipedia:Hydrierkatalysatoren|Hydrierkatalysatoren]] wie Platin – nur schwach ausgeprägt.<ref name="PhDHohmeyer">J. Hohmeyer: [http://tuprints.ulb.tu-darmstadt.de/2231/ ''Charakterisierung von Silberkatalysatoren für die Selektivhydrierung mittels DRIFT-Spektroskopie, Adsorptionskalorimetrie und TAP-Reaktor.''] [[Wikipedia:Dissertation|Dissertation]]. Fritz-Haber-Institut Berlin / Technische Universität Darmstadt, 2009.</ref> Ag-Katalysatoren sind deshalb in der Lage, Doppelbindungen von bi-/multifunktionellen Molekülen selektiv zu hydrieren (z. B. Hydrierung von Acrolein zu Allylalkohol). |
| − | Silber ist mit vielen Metallen legierbar. Gut legieren lässt es sich mit Gold, [[Kupfer-Silber-Legierungen|mit Kupfer]] oder mit [[Palladium]] (ein Palladiumgehalt von 20 bis 30 Prozent macht das Silber [[Anlaufen (Metallurgie)|anlaufbeständig]]). In begrenztem Maße lässt sich Silber mit [[Chrom]], [[Mangan]] oder Nickel legieren. Legieren erhöht zumeist die Härte des Silbers. Mit [[Cobalt]] oder [[Eisen]] lässt es sich nicht legieren. | + | |
| + | ===Nichtmetallische und nicht bakterizide Silberanwendungen=== | ||
| + | Silber wird als [[Wikipedia:Lebensmittelfarbstoff|Lebensmittelfarbstoff]] E 174 auch im Speisenbereich verwendet, zum Beispiel für Überzüge von [[Wikipedia:Süßware|Süßware]]n wie etwa Pralinen und in [[Wikipedia:Likör|Likör]]en. [[Wikipedia:Silbersalz|Silbersalz]]e färben [[Wikipedia:Glas|Glas]] und [[Wikipedia:Email|Email]]le gelb. | ||
| + | |||
| + | ==Silberlegierungen== | ||
| + | Silber ist mit vielen Metallen legierbar. Gut legieren lässt es sich mit Gold, [[Kupfer-Silber-Legierungen|mit Kupfer]] oder mit [[Wikipedia:Palladium|Palladium]] (ein Palladiumgehalt von 20 bis 30 Prozent macht das Silber [[Wikipedia:Anlaufen (Metallurgie)|anlaufbeständig]]). In begrenztem Maße lässt sich Silber mit [[Wikipedia:Chrom|Chrom]], [[Wikipedia:Mangan|Mangan]] oder Nickel legieren. Legieren erhöht zumeist die Härte des Silbers. Mit [[Wikipedia:Cobalt|Cobalt]] oder [[Eisen]] lässt es sich nicht legieren. | ||
[[Datei:Silberpunzierung.jpg|200px|mini|Stempel auf silbernem Gerät: links Halbmond und Reichskrone, Mitte Feingehaltzahl, rechts Firmenstempel]] | [[Datei:Silberpunzierung.jpg|200px|mini|Stempel auf silbernem Gerät: links Halbmond und Reichskrone, Mitte Feingehaltzahl, rechts Firmenstempel]] | ||
| − | Die wichtigsten [[Legierung|Silberlegierungen]] sind heute [[Kupfer]]-Silber-Legierungen. Sie werden meist nach ihrem [[Feingehalt]] an Silber, angegeben in Tausendstel, bezeichnet. Die gebräuchlichsten Silberlegierungen haben einen Feingehalt von 800, 835, 925 und 935 Tausendstel Teile Silber. 925er Silber wird nach der britischen Währung [[Pfund Sterling]] als [[Sterlingsilber]] bezeichnet. Es gilt als die wichtigste Silberlegierung und wird u. a. zur Herstellung von Münzen, Schmuck und Besteck verwendet. | + | Die wichtigsten [[Wikipedia:Legierung|Silberlegierungen]] sind heute [[Kupfer]]-Silber-Legierungen. Sie werden meist nach ihrem [[Wikipedia:Feingehalt|Feingehalt]] an Silber, angegeben in Tausendstel, bezeichnet. Die gebräuchlichsten Silberlegierungen haben einen Feingehalt von 800, 835, 925 und 935 Tausendstel Teile Silber. 925er Silber wird nach der britischen Währung [[Wikipedia:Pfund Sterling|Pfund Sterling]] als [[Wikipedia:Sterlingsilber|Sterlingsilber]] bezeichnet. Es gilt als die wichtigste Silberlegierung und wird u. a. zur Herstellung von Münzen, Schmuck und Besteck verwendet. |
| − | Im Hinblick auf den [[Export]] werden heute [[Korpusware]]n vorwiegend aus einer Silberlegierung mit einem Feingehalt von 935/1000 hergestellt, da die Waren mit Silberloten [[Löten|gelötet]] werden, deren Feingehalt niedriger ist, um letztendlich dem gesetzlich geforderten Gesamtfeingehalt von beispielsweise 925/1000 zu genügen. Eine neuartige Legierung aus England ist Argentium<sup>™</sup> Sterling Silber, das nicht anlaufen soll. Auch bei stark beanspruchten Bestecken geht seit Jahren der Trend zum Sterlingsilber. Silberwaren werden in der Regel abschließend feinversilbert, Bestecke und Verschleißartikel hartversilbert. Durch die reine Silberbeschichtung werden die verkaufsfördernde, strahlendweiße Silberfarbe und ein stark vermindertes Anlaufen der Waren erreicht. | + | Im Hinblick auf den [[Wikipedia:Export|Export]] werden heute [[Wikipedia:Korpusware|Korpusware]]n vorwiegend aus einer Silberlegierung mit einem Feingehalt von 935/1000 hergestellt, da die Waren mit Silberloten [[Wikipedia:Löten|gelötet]] werden, deren Feingehalt niedriger ist, um letztendlich dem gesetzlich geforderten Gesamtfeingehalt von beispielsweise 925/1000 zu genügen. Eine neuartige Legierung aus England ist Argentium<sup>™</sup> Sterling Silber, das nicht anlaufen soll. Auch bei stark beanspruchten Bestecken geht seit Jahren der Trend zum Sterlingsilber. Silberwaren werden in der Regel abschließend feinversilbert, Bestecke und Verschleißartikel hartversilbert. Durch die reine Silberbeschichtung werden die verkaufsfördernde, strahlendweiße Silberfarbe und ein stark vermindertes Anlaufen der Waren erreicht. |
| − | Eine im Mittelalter für die Verzierung von Kunstwerken verwendete Silberlegierung ist das [[Tulasilber]], eine Legierung von Silber, Kupfer, Blei und Schwefel. Silber wird häufig auch [[Feuervergoldung|vergoldet]]; man nennt es mit einem aus dem Französischen beziehungsweise Lateinischen stammenden Wort dann „Vermeil“. | + | Eine im Mittelalter für die Verzierung von Kunstwerken verwendete Silberlegierung ist das [[Wikipedia:Tulasilber|Tulasilber]], eine Legierung von Silber, Kupfer, Blei und Schwefel. Silber wird häufig auch [[Wikipedia:Feuervergoldung|vergoldet]]; man nennt es mit einem aus dem Französischen beziehungsweise Lateinischen stammenden Wort dann „Vermeil“. |
| − | == Verbindungen == | + | ==Verbindungen== |
| − | Silber kommt in [[Chemische Verbindung|chemischen Verbindungen]] hauptsächlich in der [[Oxidationsstufe]] +I vor, die [[Oxidationsstufen]] +II, +III und +IV sind selten und meist nur in [[Komplex (Chemie)|Komplexen]] stabil. | + | Silber kommt in [[Wikipedia:Chemische Verbindung|chemischen Verbindungen]] hauptsächlich in der [[Wikipedia:Oxidationsstufe|Oxidationsstufe]] +I vor, die [[Wikipedia:Oxidationsstufen|Oxidationsstufen]] +II, +III und +IV sind selten und meist nur in [[Wikipedia:Komplex (Chemie)|Komplexen]] stabil. |
| − | === Oxide === | + | ===Oxide=== |
| − | *[[Silber(I)-oxid]] Ag<sub>2</sub>O ist ein dunkelbrauner [[Feststoff]], der aus silberhaltigen [[Lösung (Chemie)|Lösungen]] mit [[Basen (Chemie)|Basen]], z. B. [[Natronlauge]], ausfällt. Bei höheren [[Temperatur]]en zerfällt Ag<sub>2</sub>O in die [[Chemisches Element|Elemente]]. | + | *[[Wikipedia:Silber(I)-oxid|Silber(I)-oxid]] Ag<sub>2</sub>O ist ein dunkelbrauner [[Wikipedia:Feststoff|Feststoff]], der aus silberhaltigen [[Wikipedia:Lösung (Chemie)|Lösungen]] mit [[Wikipedia:Basen (Chemie)|Basen]], z. B. [[Wikipedia:Natronlauge|Natronlauge]], ausfällt. Bei höheren [[Wikipedia:Temperatur|Temperatur]]en zerfällt Ag<sub>2</sub>O in die [[Chemisches Element|Elemente]]. |
| − | Die [[Silberoxid]]e mit Silber in Oxidationsstufen größer +I können nur auf [[Elektrochemie|elektrochemischem]] Wege dargestellt werden. Dies sind die Verbindungen [[Silber(I,III)-oxid]] AgO, [[Silber(II,III)-oxid]] Ag<sub>3</sub>O<sub>4</sub> und [[Silber(III)-oxid]] Ag<sub>2</sub>O<sub>3</sub>. | + | Die [[Wikipedia:Silberoxid|Silberoxid]]e mit Silber in Oxidationsstufen größer +I können nur auf [[Wikipedia:Elektrochemie|elektrochemischem]] Wege dargestellt werden. Dies sind die Verbindungen [[Wikipedia:Silber(I,III)-oxid|Silber(I,III)-oxid]] AgO, [[Silber(II,III)-oxid]] Ag<sub>3</sub>O<sub>4</sub> und [[Silber(III)-oxid]] Ag<sub>2</sub>O<sub>3</sub>. |
| − | === Halogenide === | + | ===Halogenide=== |
| − | [[Datei:Chlorargyrite-303687.jpg|mini|[[Silberchlorid]] in Form eines [[Chlorargyrit]]-[[Kristall]]s]] | + | [[Datei:Chlorargyrite-303687.jpg|mini|[[Wikipedia:Silberchlorid|Silberchlorid]] in Form eines [[Wikipedia:Chlorargyrit|Chlorargyrit]]-[[Wikipedia:Kristall|Kristall]]s]] |
| − | Zu den wichtigsten Silberverbindungen zählen die Silberhalogenide. Sie zersetzen sich im [[Licht]] und werden deshalb in der [[Analogfotografie]] gebraucht. Silberhalogenide sind außer dem [[Fluoride|Fluorid]] schwer in [[Wasserlöslichkeit|Wasser löslich]] und dienen zum [[Nachweis (Chemie)|Nachweis]] von [[Halogenid]]-[[Ion]]en. | + | Zu den wichtigsten Silberverbindungen zählen die Silberhalogenide. Sie zersetzen sich im [[Wikipedia:Licht|Licht]] und werden deshalb in der [[Wikipedia:Analogfotografie|Analogfotografie]] gebraucht. Silberhalogenide sind außer dem [[Wikipedia:Fluoride|Fluorid]] schwer in [[Wikipedia:Wasserlöslichkeit|Wasser löslich]] und dienen zum [[Wikipedia:Nachweis (Chemie)|Nachweis]] von [[Wikipedia:Halogenid|Halogenid]]-[[Wikipedia:Ion|Ion]]en. |
| − | *[[Silber(I)-fluorid]] AgF ist farblos und als einziges Silberhalogenid gut wasserlöslich. Es ist im Gegensatz zu den anderen Silberhalogeniden nicht [[Photochemie|lichtempfindlich]]. | + | *[[Wikipedia:Silber(I)-fluorid|Silber(I)-fluorid]] AgF ist farblos und als einziges Silberhalogenid gut wasserlöslich. Es ist im Gegensatz zu den anderen Silberhalogeniden nicht [[Wikipedia:Photochemie|lichtempfindlich]]. |
| − | *[[Silberchlorid|Silber(I)-chlorid]] AgCl ist ein weißes, [[kristall]]ines wasserunlösliches Pulver. Es dient als Nachweis für [[Chloride|Chloridionen]]. Außerdem wird es in [[Referenzelektrode]]n und in der [[Analogfotografie]] verwendet. | + | *[[Wikipedia:Silberchlorid|Silber(I)-chlorid]] AgCl ist ein weißes, [[Wikipedia:kristall|kristall]]ines wasserunlösliches Pulver. Es dient als Nachweis für [[Wikipedia:Chloride|Chloridionen]]. Außerdem wird es in [[Wikipedia:Referenzelektrode|Referenzelektrode]]n und in der [[Wikipedia:Analogfotografie|Analogfotografie]] verwendet. |
| − | *[[Silberbromid|Silber(I)-bromid]] ist hellgelb und ebenfalls wasserunlöslich. Da es lichtempfindlicher als Silberchlorid ist, dient es sehr häufig als lichtempfindliche Schicht in der Analogfotografie. | + | *[[Wikipedia:Silberbromid|Silber(I)-bromid]] ist hellgelb und ebenfalls wasserunlöslich. Da es lichtempfindlicher als Silberchlorid ist, dient es sehr häufig als lichtempfindliche Schicht in der Analogfotografie. |
| − | *[[Silberiodid|Silber(I)-iodid]] ist wie Silberbromid gelb und wasserunlöslich. Es wird selten auch in der Analogfotografie verwendet. Manchmal wird Silberiodid von [[Flugzeug]]en als [[Kondensationskern|Kondensationskeim]] zur Regenbildung versprüht. | + | *[[Wikipedia:Silberiodid|Silber(I)-iodid]] ist wie Silberbromid gelb und wasserunlöslich. Es wird selten auch in der Analogfotografie verwendet. Manchmal wird Silberiodid von [[Wikipedia:Flugzeug|Flugzeug]]en als [[Wikipedia:Kondensationskern|Kondensationskeim]] zur Regenbildung versprüht. |
| − | *[[Silber(II)-fluorid]] AgF<sub>2</sub> ist eines der wenigen nicht komplexen zweiwertigen [[Silbersalze]]. Es wird als Fluorierungsmittel an Stelle von elementarem [[Fluor]] verwendet. | + | *[[Wikipedia:Silber(II)-fluorid|Silber(II)-fluorid]] AgF<sub>2</sub> ist eines der wenigen nicht komplexen zweiwertigen [[Wikipedia:Silbersalze|Silbersalze]]. Es wird als Fluorierungsmittel an Stelle von elementarem [[Wikipedia:Fluor|Fluor]] verwendet. |
| − | === Weitere Verbindungen === | + | ===Weitere Verbindungen=== |
| − | *[[Datei:Silver-fulminate-cyclic-hexamer-from-trigonal-xtal-3D-balls-B.png|mini|[[Stäbchenmodell]] von [[Silberfulminat]]-[[Oligomer|Hexamer]]]][[Silbersulfid|Silber(I)-sulfid]] Ag<sub>2</sub>S ist von allen [[Silbersalze]]n am schwersten [[Wasserlöslichkeit|wasserlöslich]]. Es ist schwarz und entsteht direkt aus den [[Chemisches Element|Elementen]] oder durch Versetzen silberhaltigen [[Lösung (Chemie)|Lösungen]] mit [[Schwefelwasserstoff]]. Wenn [[Silberbesteck]] anläuft, besteht der dunkle Überzug ebenfalls aus Silbersulfid. | + | *[[Datei:Silver-fulminate-cyclic-hexamer-from-trigonal-xtal-3D-balls-B.png|mini|[[Wikipedia:Stäbchenmodell|Stäbchenmodell]] von [[Wikipedia:Silberfulminat|Silberfulminat]]-[[Wikipedia:Oligomer|Hexamer]]]][[Wikipedia:Silbersulfid|Silber(I)-sulfid]] Ag<sub>2</sub>S ist von allen [[Wikipedia:Silbersalze|Silbersalze]]n am schwersten [[Wikipedia:Wasserlöslichkeit|wasserlöslich]]. Es ist schwarz und entsteht direkt aus den [[Chemisches Element|Elementen]] oder durch Versetzen silberhaltigen [[Wikipedia:Lösung (Chemie)|Lösungen]] mit [[Wikipedia:Schwefelwasserstoff|Schwefelwasserstoff]]. Wenn [[Wikipedia:Silberbesteck|Silberbesteck]] anläuft, besteht der dunkle Überzug ebenfalls aus Silbersulfid. |
| − | *[[Silbernitrat]] AgNO<sub>3</sub> ist die wichtigste Silberverbindung und Ausgangsstoff für die [[Herstellung]] der meisten anderen Silberverbindungen. Es ist leicht wasserlöslich und wird durch Auflösen von Silber in [[Salpetersäure]] hergestellt. | + | *[[Wikipedia:Silbernitrat|Silbernitrat]] AgNO<sub>3</sub> ist die wichtigste Silberverbindung und Ausgangsstoff für die [[Wikipedia:Herstellung|Herstellung]] der meisten anderen Silberverbindungen. Es ist leicht wasserlöslich und wird durch Auflösen von Silber in [[Wikipedia:Salpetersäure|Salpetersäure]] hergestellt. |
| − | *[[Silbersulfat]] Ag<sub>2</sub>SO<sub>4</sub> entsteht beim Auflösen von Silber in [[Konzentration (Chemie)|konzentrierter]] [[Schwefelsäure]]. | + | *[[Wikipedia:Silbersulfat|Silbersulfat]] Ag<sub>2</sub>SO<sub>4</sub> entsteht beim Auflösen von Silber in [[Wikipedia:Konzentration (Chemie)|konzentrierter]] [[Wikipedia:Schwefelsäure|Schwefelsäure]]. |
| − | *[[Silberazid]] AgN<sub>3</sub> und [[Silberacetylid]] Ag<sub>2</sub>C<sub>2</sub> sind hochexplosiv. Ersteres kann als [[Initialzünder]] von [[Sprengstoff]]en dienen. Das ebenfalls sehr explosive [[Silberfulminat]] AgCNO wird auch als Knallsilber bezeichnet. | + | *[[Wikipedia:Silberazid|Silberazid]] AgN<sub>3</sub> und [[Wikipedia:Silberacetylid|Silberacetylid]] Ag<sub>2</sub>C<sub>2</sub> sind hochexplosiv. Ersteres kann als [[Wikipedia:Initialzünder|Initialzünder]] von [[Wikipedia:Sprengstoff|Sprengstoff]]en dienen. Das ebenfalls sehr explosive [[Wikipedia:Silberfulminat|Silberfulminat]] AgCNO wird auch als Knallsilber bezeichnet. |
| − | *[[Silbercyanid]] AgCN ist ein hochgiftiges farbloses Pulver, das beim Versetzen von Silbersalzlösungen mit Cyanidionen ausfällt. | + | *[[Wikipedia:Silbercyanid|Silbercyanid]] AgCN ist ein hochgiftiges farbloses Pulver, das beim Versetzen von Silbersalzlösungen mit Cyanidionen ausfällt. |
| − | Silber in höheren [[Oxidationsstufen]] tritt beispielsweise im Tetrapyridinosilber(II)-persulfat – [Ag(C<sub>5</sub>H<sub>5</sub>N)<sub>4</sub>]S<sub>2</sub>O<sub>8</sub>, im Kaliumtetrafluoroargentat(III) K[AgF<sub>4</sub>] oder Caesiumhexafluoroargentat(IV) Cs<sub>2</sub>[AgF<sub>6</sub>] auf. Die giftigen [[Silbercyanid]]e werden u. a. in [[Galvanotechnik|galvanischen]] Bädern zur [[Versilbern|Versilberung]] und Farbvergoldung (hellgelb-grünlichgelb) eingesetzt. Bei Silber(I) ist die Neigung zur Bildung von [[Komplexchemie|Komplexionen]] ausgeprägt, meist mit der [[Koordinationszahl]] 2. Diese Komplexionen sind mit Ausnahme des erst in stark [[Salzsäure|salzsaurer]] Lösung entstehenden [AgCl<sub>2</sub>]<sup>−</sup> nur in [[Alkalische Lösung|alkalischer]] oder [[Neutrale Lösung|neutraler Lösung]] [[Chemische Beständigkeit|beständig]]. | + | Silber in höheren [[Wikipedia:Oxidationsstufen|Oxidationsstufen]] tritt beispielsweise im Tetrapyridinosilber(II)-persulfat – [Ag(C<sub>5</sub>H<sub>5</sub>N)<sub>4</sub>]S<sub>2</sub>O<sub>8</sub>, im Kaliumtetrafluoroargentat(III) K[AgF<sub>4</sub>] oder Caesiumhexafluoroargentat(IV) Cs<sub>2</sub>[AgF<sub>6</sub>] auf. Die giftigen [[Wikipedia:Silbercyanid|Silbercyanid]]e werden u. a. in [[Wikipedia:Galvanotechnik|galvanischen]] Bädern zur [[Wikipedia:Versilbern|Versilberung]] und Farbvergoldung (hellgelb-grünlichgelb) eingesetzt. Bei Silber(I) ist die Neigung zur Bildung von [[Wikipedia:Komplexchemie|Komplexionen]] ausgeprägt, meist mit der [[Wikipedia:Koordinationszahl|Koordinationszahl]] 2. Diese Komplexionen sind mit Ausnahme des erst in stark [[Wikipedia:Salzsäure|salzsaurer]] Lösung entstehenden [AgCl<sub>2</sub>]<sup>−</sup> nur in [[Wikipedia:Alkalische Lösung|alkalischer]] oder [[Wikipedia:Neutrale Lösung|neutraler Lösung]] [[Wikipedia:Chemische Beständigkeit|beständig]]. |
| − | == Nachweis == | + | ==Nachweis== |
[[Datei:Silberchlorid.jpg|mini|Silberchlorid (links);<br /> nach Zugabe von Ammoniak (rechts)]] | [[Datei:Silberchlorid.jpg|mini|Silberchlorid (links);<br /> nach Zugabe von Ammoniak (rechts)]] | ||
[[Datei:Silberhalogenide.jpg|mini|Silberhalogenide im Vergleich, von links nach rechts: Silberchlorid, -bromid, -iodid]] | [[Datei:Silberhalogenide.jpg|mini|Silberhalogenide im Vergleich, von links nach rechts: Silberchlorid, -bromid, -iodid]] | ||
| − | Beim Zutropfen von [[Halogenid]]-Lösung in die zu prüfende Flüssigkeit bilden sich beim Vorhandensein von Silber-Kationen Niederschläge, z. B.: | + | Beim Zutropfen von [[Wikipedia:Halogenid|Halogenid]]-Lösung in die zu prüfende Flüssigkeit bilden sich beim Vorhandensein von Silber-Kationen Niederschläge, z. B.: |
| + | |||
| + | :Ag<sup>+</sup><sub>(aq)</sub> + Cl<sup>−</sup><sub>(aq)</sub> → AgCl <sub>(s)</sub> | ||
| + | |||
| + | Als [[Wikipedia:Nachweisreaktion|Nachweisreaktion]] für Silbersalze erfolgt daher die Zugabe von Salzsäure oder Natriumchloridlösung. Es bildet sich ein weißer Niederschlag von Silberchlorid, der löslich in verdünntem [[Wikipedia:Ammoniakwasser|Ammoniakwasser]] ist, wobei der Silberdiamminkomplex [Ag(NH<sub>3</sub>)<sub>2</sub>]<sup>+</sup> entsteht. Bei hohen Konzentrationen an Chlorid löst sich das Silberchlorid teilweise wieder auf, da sich komplexe Dichloroargentate(I) bilden: | ||
| − | : | + | :AgCl + Cl<sup>−</sup> → [AgCl<sub>2</sub>]<sup>−</sup> |
| − | + | Der Niederschlag ist bei Iodid-Ionen ([[Wikipedia:Silberiodid|AgI]]) gelb-grünlich und in Ammoniakwasser unlöslich, bei Chlorid- und Bromid-Ionen ([[Wikipedia:Silberchlorid|AgCl]], [[Wikipedia:Silberbromid|AgBr]]) weißlich. | |
| − | : | + | ==Heraldik== |
| + | In der [[Wikipedia:Heraldik|Heraldik]] wird Silber, wie auch [[Gold]], als [[Wikipedia:Tingierung#Metalle|Metall]] bezeichnet, das zu den heraldischen Tinkturen zählt. Es wird häufig durch weiße Farbe wiedergegeben. | ||
| − | + | ==Siehe auch== | |
| − | + | *{{WikipediaDE|Kategorie:Silber}} (Link zur Kategorie Silber auf Wikipedia) | |
| − | + | *{{WikipediaDE|Silber}} | |
| + | *{{WikipediaDE|Silber/Tabellen und Grafiken}} | ||
| + | *{{WikipediaDE|Silberelektrolyte}} | ||
| + | *{{WikipediaDE|Galvanisierung}} | ||
| − | == | + | ==Literatur== |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == | + | *{{Holleman-Wiberg|Auflage=102 |Startseite=1452 |Endseite=1466}} |
| − | * Günter Ludwig, Günter Wermusch: ''Silber. Aus der Geschichte eines Edelmetalls.'' Verlag Die Wirtschaft, Berlin 1986, ISBN 3-349-00101-7. | + | *Günter Ludwig, [[Wikipedia:Günter Wermusch|Günter Wermusch]]: ''Silber. Aus der Geschichte eines Edelmetalls.'' Verlag Die Wirtschaft, Berlin 1986, ISBN 3-349-00101-7. |
| − | == Weblinks == | + | ==Weblinks== |
{{Commonscat|Silver|Silber}} | {{Commonscat|Silver|Silber}} | ||
{{Wiktionary}} | {{Wiktionary}} | ||
{{Wikiquote}} | {{Wikiquote}} | ||
{{Wikibooks|Praktikum Anorganische Chemie/ Silber}} | {{Wikibooks|Praktikum Anorganische Chemie/ Silber}} | ||
| + | * Mineralienatlas – [[Mineralienatlas:Silber|Silber (Bilder, Vorkommen, technische Fakten)]], [[Mineralienatlas:Mineralienportrait/Silber|Mineralienportrait Silber]] | ||
| − | == Einzelnachweise == | + | ==Einzelnachweise== |
<references /> | <references /> | ||
| Zeile 307: | Zeile 317: | ||
{{Wikipedia}} | {{Wikipedia}} | ||
| + | [[Kategorie:Wikipedialinks mit lokalen Entsprechungen]] | ||
Aktuelle Version vom 28. Juni 2022, 12:19 Uhr
Silber ist ein chemisches Element mit dem Elementsymbol Ag und der Ordnungszahl 47. Es zählt zu den Übergangsmetallen. Im Periodensystem steht es in der 5. Periode und der 1. Nebengruppe (Gruppe 11) oder Kupfergruppe. Das Elementsymbol Ag leitet sich vom lateinischen Wort argentum für „Silber“ ab. Silber gehört zu den Edelmetallen.
Es ist ein weiches, gut verformbares (duktiles) Schwermetall mit der höchsten elektrischen Leitfähigkeit aller Elemente im unmodifizierten Zustand (Kohlenstoff in der Form von Graphen besitzt nochmals eine höhere Leitfähigkeit) und der höchsten thermischen Leitfähigkeit aller Metalle. Lediglich Supraflüssigkeiten und ungestörte kristalline Ausprägungen des Kohlenstoffs (Diamant, Graphen und graphennaher Graphit, Kohlenstoffnanoröhren) und des Bornitrids weisen eine bessere thermische Leitfähigkeit auf.[1]
Etymologie
Das Wort „Silber“ (althochdeutsch silabar, silbar und ähnliche Formen) leitet sich aus der gemeingermanischen Wurzel *silubra- ab, ebenso wie die Bezeichnungen in anderen germanischen Sprachen (so Englisch silver). Das Baskische hat das germanische Wort übernommen: zilar. Verwandte Bezeichnungen gibt es in den baltischen Sprachen (litauisch sidabras) und den slawischen Sprachen (russisch серебро serebro, kroatisch srebro).[2]
Die Philologie des 19. Jahrhunderts brachte eine Vielzahl von Theorien über den Wortursprung hervor.[2] Der 1870 von Victor Hehn hergestellte Zusammenhang mit dem in Homers Ilias beschriebenen sagenhaften Land Alybē (Ἀλύβη) muss Spekulation bleiben. Das Wort könnte aus einer orientalischen Sprache stammen, abgeleitet von der semitischen Wurzel ṢRP (vgl. akkadisch ṣarāpu, „veredeln, legieren“).[3]
In anderen indogermanischen Sprachen geht das Wort für Silber auf die Wurzel *arg zurück, so altgriechisch ἄργυρος argyros und lateinisch argentum.[4] Argentinien wurde nach dem Silber benannt, das Europäer dort zu finden hofften; es ist das einzige nach einem chemischen Element benannte Land. Häufiger ist die Namensgebung eines Elementes nach einem Land, z. B. Francium, Germanium und Polonium.[5]
Geschichte
Silber wird von Menschen etwa seit dem 5. Jahrtausend v. Chr. verarbeitet. Es wurde zum Beispiel von den Assyrern, den Goten, den Griechen, den Römern, den Ägyptern und den Germanen benutzt. Zeitweise galt es als wertvoller als Gold. Das Silber stammte meistens aus den Minen in Laurion, die etwa 50 Kilometer südlich von Athen lagen. Bei den alten Ägyptern war Silber als Mondmetall bekannt.
Im Mittelalter und der Frühen Neuzeit wurden in Zentraleuropa Silbererzvorkommen im Harz (Goslar), in Waldeck-Frankenberg (Frankenberg, Goddelsheim, Dorfitter, Thalitter), am Donnersberg (Imsbach), im Thüringer Wald (Ohrdruf), in Sachsen (Freiberg und im übrigen Erzgebirge, besonders Jáchymov), im Südschwarzwald (Schauinsland, Belchen, Münstertal, Feldberg), Böhmen (Kutná Hora) und der Slowakei entdeckt. Ergiebige Silbervorkommen sind darüber hinaus aus Kongsberg (Norwegen) bekannt.
Größter Silberproduzent im Mittelalter war Schwaz. Bis zu 80 % des damaligen Silbers kam aus den Stollen der Schwazer Knappen.
Später brachten die Spanier große Mengen von Silber aus Lateinamerika, unter anderem aus der sagenumwobenen Mine von Potosí, nach Europa. Auch Japan war im 16. Jahrhundert Silberexporteur. Durch das gestiegene Angebot sank der Silberwert in der Alten Welt.
Da nach 1870 vorwiegend Gold als Währungsmetall verwendet wurde, verlor das Silber seine wirtschaftliche Bedeutung immer mehr. Das Wertverhältnis sank von 1:14 einige Zeit lang auf 1:100, später stieg es wieder etwas an. Im März 2018 lag es bei ungefähr 1:81. Das Angebot an Silber ist von der Verbrauchs- und Produktionsentwicklung anderer Metalle abhängig.
Mitte des 19. Jahrhunderts wurde rostfreier Stahl entwickelt, der dann aufgrund seiner Gebrauchsfreundlichkeit und des attraktiven Preises nach dem Ersten Weltkrieg in die Einsatzbereiche des Silbers vordrang, etwa Servierplatten, Bestecke, Leuchter und Küchengerät. Gegenläufig dazu hat sich der Bereich Fotografie und Fotochemie unter Verwendung der Silbersalze während des ganzen 20. Jahrhunderts breit entwickelt, verlor aber seit Ende der 1990er Jahre im Zuge der Umstellung auf die digitale Abbildungstechnik erheblich an Bedeutung.
Als die größte Silberspekulation wird die Spekulationsblase im Silbermarkt Mitte der 1970er Jahre bis zum Jahr 1980 betrachtet, die insbesondere mit den Brüdern Nelson Bunker Hunt und William Herbert Hunt in Verbindung gebracht wird, die Silberspekulation der Brüder Hunt.
Silber als Mineral und Varietäten
Silber hat in der Erdkruste einen Anteil von etwa 0,079 ppm. Es ist damit etwa 20 mal häufiger als Gold und rund 700 mal seltener als Kupfer. In der Natur tritt es gediegen auf, das heißt elementar; meist in Form von Körnern, seltener von größeren Nuggets, dünnen Plättchen und Blechen oder als drahtig verästeltes Geflecht (Dendrit) bzw. als dünne Silberdrähte in hydrothermal gebildeten Erzgängen sowie im Bereich der Zementationszone.
Natürliche Vorkommen an gediegen Silber waren bereits vor der Gründung der International Mineralogical Association (IMA) bekannt. Silber ist daher als sogenanntes grandfathered Mineral als eigenständige Mineralart anerkannt.[6]
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Silber unter der System-Nr. „1.AA.05“ (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe)[7] beziehungsweise in der veralteten 8. Auflage unter I/A.01 (Kupfer-Reihe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. „01.01.01.02“ (Goldgruppe).[8]
Neben gediegen Silber, von dem bisher (Stand: 2018) über 5500 Fundorte dokumentiert sind,[9] findet man es vor allem in sulfidischen Mineralen. Zu den wichtigsten sulfidischen Silbererzen zählen unter anderem Akanthit (Silberglanz) Ag2S mit einem Silbergehalt von etwa 87 % und Stromeyerit (Kupfersilberglanz) CuAgS mit etwa 53 % Silberanteil. Das Mineral mit dem höchsten Silberanteil von maximal 99 % ist allerdings das selten vorkommende Allargentum. Ebenfalls selten vorkommende Silberminerale sind unter anderem der Chlorargyrit (veraltet Hornerz bzw. Silberhornerz) AgCl und der Miargyrit (Silberantimonglanz) AgSbS2. Insgesamt sind einschließlich gediegen Silber bisher (Stand: 2018) 167 Silberminerale bekannt.[10]
Neben diesen Silbererzen findet man noch sogenannte silberhaltige Erze, die meist nur geringe Mengen Silber (0,01–1 %) enthalten. Dies sind häufig Galenit (PbS) und Chalkopyrit (CuFeS2). Aus diesem Grund wird Silber häufig als Nebenprodukt bei der Blei- oder Kupferherstellung gewonnen.
Ein als Kongsbergit bezeichnetes Silberamalgam mit einem Quecksilbergehalt von etwa 5 % wird als Varietät dem Silber zugerechnet. Bekannt ist Kongsbergit bisher von etwas mehr als 30 Fundorten.[11]
Als Arquerit wird eine Silbervarietät (Silberamalgam) mit einem Quecksilbergehalt von 10 bis 15 % bezeichnet.[12]
Chilenit ist eine bismuthaltige Silbervarietät.[12]
Eine Silbervarietät mit einem Gehalt zwischen 10 und 30 % Gold ist unter der Bezeichnung Küstelit bekannt und konnte bisher (Stand: 2011) an rund 60 Fundorten nachgewiesen werden.[13]
Seit dem 18. Jahrhundert ist bekannt, dass durch Erhitzen von Akanthit bzw. bei Verhüttungsprozessen von Silbererzen künstlich (anthropogen) erzeugte Silberdrähte, meist in Form von Silberlocken entstehen können.[14] Besonders in den letzten Jahrzehnten wurde wiederholt über die künstliche Erzeugung von Silberlocken auf Akanthitstufen[15] in der Fachliteratur berichtet.
Vorkommen und Förderung
Die wichtigsten Silbervorkommen befinden sich in Nordamerika (Mexiko, den USA und Kanada) und in Südamerika (Peru, Bolivien). Mit knapp 20 % der globalen Förderung war Peru von 2003 bis 2009 der weltweit größte Silberproduzent und wurde 2010 von Mexiko überholt.[16] Im Jahr 2017 förderte Mexiko mit 6110 t weltweit das meiste Silber, gefolgt von Peru mit 4300 t.[17]
Das meiste Silber wird aus Silbererzen gewonnen, die oft zusammen mit Blei-, Kupfer- und Zinkerzen als Sulfide oder Oxide vorkommen. Wichtige Fundorte von Silber in gediegener Form waren: Freiberg im Erzgebirge; Schwaz (Tirol); Kongsberg/Norwegen (dort auch große Kristalle); Sankt Andreasberg im Harz; Keweenaw-Halbinsel/USA (dort mit ebenfalls gediegen vorkommendem Kupfer als „halfbreed“); Batopilas/Mexiko; Mansfelder Kupferschiefer-Revier (Eisleben, Sangerhausen; meist Silberbleche; auch als Versteinerungsmaterial von Fossilien).
Zwischen dem Beginn des 20. Jahrhunderts und dem Ende des Zweiten Weltkrieges hat die jährlich geförderte Silbermenge zwar fluktuiert, ist aber im Mittel konstant geblieben. Vom Kriegsende bis heute hat sie sich mehr als verdoppelt.
Das polnische Unternehmen KGHM ist mit durchschnittlich 1.200 Tonnen Jahresförderung das bedeutendste Silberunternehmen der EU und das drittgrößte weltweit.
Laut einer Studie des Rheinisch-Westfälischen Instituts für Wirtschaftsforschung, des Fraunhofer-Instituts für System- und Innovationsforschung sowie der Bundesanstalt für Geowissenschaften und Rohstoffe beträgt die weltweite Reichweite der Silberressourcen nur noch 29 Jahre. Somit ist mit einer Verknappung von Silber in den nächsten Jahrzehnten zu rechnen. Allerdings wird auch immer mehr Silber recycelt, wodurch die bekannten Vorkommen geschont werden.[18] Ausgehend von den Daten des U.S. Geological Survey vom Januar 2019[17] ergibt sich für Silber in Bezug auf das Jahr 2017 eine statische Reichweite von 21 Jahren.
Wie bei den anderen Edelmetallen spielt die Wiederaufarbeitung silberhaltiger Materialien im Rahmen des Recyclings, beispielsweise von Fotopapieren, Röntgenfilmen, Entwickler- und Fixierbädern, Elektronikschrott und Batterien eine wichtige Rolle.
| Rang | Land | Fördermengen (in t) |
Rang | Land | Fördermengen (in t) | |
|---|---|---|---|---|---|---|
| 1 | Vorlage:MEX | 6110 | 7 | Vorlage:AUS | 1200 | |
| 2 | Vorlage:PER | 4300 | 8 | Vorlage:RUS | 1120 | |
| 3 | Vorlage:CHN | 3500 | 9 | Vorlage:USA | 1030 | |
| 4 | Vorlage:POL | 1290 | 10 | Vorlage:ARG | 1020 | |
| 5 | Vorlage:CHI | 1260 | übrige | 4770 | ||
| 6 | Vorlage:BOL | 1240 | Summe | 26800 | ||
Gewinnung und Darstellung
Gewinnung aus Silbererzen
20 % des Silbers wird aus Silbererzen gewonnen. Aus diesen wird das Silber meist durch Cyanidlaugung mit Hilfe einer 0,1%igen Natriumcyanid-Lösung herausgelöst. Dazu wird das Erz zunächst fein zu einem Schlamm zerkleinert. Anschließend wird die Natriumcyanid-Lösung dazugegeben. Dabei ist eine gute Belüftung wichtig, da für das Verfahren Sauerstoff benötigt wird.
Bei der Zugabe von Natriumcyanid gehen sowohl elementares Silber als auch Silbererze (Ag2S, AgCl) als Dicyanoargentat(I) [Ag(CN)2]− in Lösung:
- ,
- ,
- .
Da die Reaktion von Natriumcyanid mit Silbersulfid in einem Gleichgewicht steht, muss das Natriumsulfid entweder durch Oxidation mit Sauerstoff oder durch Fällung (z. B. als Bleisulfid) entfernt werden. Anschließend fällt man das edlere Silber – ähnlich wie bei der Goldgewinnung – mit Zink aus:
- .
Das ausgefallene Rohsilber (Werksilber[19]) wird abgefiltert und weiter gereinigt (siehe Raffination).
Gewinnung aus Bleierzen
Bei der Gewinnung von Bleierzen, z. B. aus Bleiglanz, entsteht nach dem Rösten und Reduzieren das sogenannte Rohblei oder Werkblei (genauere Informationen zur Bleigewinnung im Artikel Blei). Dieses enthält meist noch einen Anteil Silber (zwischen 0,01 und 1 %). Im nächsten Schritt wird nun das Edelmetall entfernt und so dieses wertvolle Nebenprodukt gewonnen.
Zur Gewinnung muss zunächst das Silber vom größten Teil des Bleis getrennt werden. Dies geschieht durch das Verfahren des Parkesierens (nach Alexander Parkes, der dieses Verfahren 1842 erfand).[20] Das Verfahren beruht auf der unterschiedlichen Löslichkeit von Silber und Blei in Zink. Bei Temperaturen bis 400 °C sind Blei (flüssig) und Zink (fest) praktisch nicht mischbar. Zunächst wird bei Temperaturen >400 °C zum geschmolzenen Blei Zink gegeben. Danach wird die Mischung abgekühlt. Da Silber im geschmolzenen Zink leicht löslich ist, geht es in die Zinkphase über. Anschließend erstarrt die Zinkschmelze als so genannter Zinkschaum (Zink-Silber-Mischkristalle). Dadurch kann das Silber vom größten Teil des Bleis getrennt werden. Dieser Zinkschaum wird auch als Armblei bezeichnet. Er wird anschließend bis zum Schmelzpunkt des Bleis (327 °C) erhitzt, so dass ein Teil des Bleis schmilzt und entfernt werden kann. Danach wird die verbliebene Zink-Blei-Silber-Schmelze bis zum Siedepunkt des Zinks (908 °C) erhitzt und das Zink abdestilliert. Das so gewonnene Produkt wird Reichblei genannt und enthält etwa 8–12 % Silber.
Um das Silber anzureichern, wird nun die sogenannte Treibarbeit (Läuterung) durchgeführt. Dazu wird das Reichblei in einem Treibofen geschmolzen. Dann wird ein Luftstrom durch die Schmelze geleitet. Dabei oxidiert das Blei zu Bleioxid, das edle Silber bleibt hingegen unverändert. Das Bleioxid wird laufend abgeleitet und so nach und nach das Blei entfernt. Ist der Bleigehalt des Raffinats so weit gesunken, dass sich auf der Oberfläche der Metallschmelze keine matte Bleioxidschicht mehr bildet, das letzte Oxidhäutchen aufreißt und mithin das darunterliegende glänzende Silber sichtbar werden lässt, spricht man vom Silberblick. Die dann vorliegende Legierung wird Blicksilber genannt und besteht zu über 95 % aus Silber.
Gewinnung aus Kupfererzen
Silber ist auch in Kupfererzen enthalten. Bei der Kupferherstellung fällt das Silber – neben anderen Edelmetallen – im sogenannten Anodenschlamm an. Dieser wird zunächst mit Schwefelsäure und Luft vom Großteil des noch vorhandenen Kupfers befreit. Anschließend wird er im Ofen oxidierend geschmolzen, wobei enthaltene unedle Metalle in die Schlacke gehen und entfernt werden können.
Raffination

Rohsilber wird auf elektrolytischem Weg im Moebius-Verfahren gereinigt. Dazu wird das Rohsilber als Anode in eine Elektrolysezelle geschaltet. Als Kathode dient ein Feinsilberblech, als Elektrolyt salpetersaure Silbernitratlösung.
Das Verfahren entspricht der elektrolytischen Reinigung des Kupfers. Während der Elektrolyse werden Silber und alle unedleren Bestandteile des Rohsilbers (beispielsweise Kupfer oder Blei) oxidiert und gehen in Lösung. Edlere Anteile wie Gold und Platin können nicht oxidiert werden und fallen unter die Elektrode. Dort bilden sie den Anodenschlamm, der eine wichtige Quelle für Gold und andere Edelmetalle ist. An der Kathode wird nun ausschließlich Silber abgeschieden. Dieses sehr reine Silber bezeichnet man als Elektrolyt- oder Feinsilber.[21]
Eigenschaften
Physikalische Eigenschaften
Silber ist ein weißglänzendes Edelmetall. Das Metall kristallisiert im kubischen-flächenzentrierten Kristallsystem. Unter Normaldruck betragen die Schmelztemperatur 961 °C und die Siedetemperatur 2212 °C. Silber hat aber bereits oberhalb von 700 °C, also noch im festen Zustand, einen deutlichen Dampfdruck. Es siedet unter Bildung eines einatomigen, blauen Dampfes. Das Edelmetall besitzt eine Dichte von 10,49 g/cm³ (bei 20 °C) und gehört daher wie alle Edelmetalle zu den Schwermetallen.
Silber hat einen metallischen Glanz. Frische, unkorrodierte (Schnitt)flächen von Silber zeigen die höchsten Licht-Reflexionseigenschaften aller Metalle, frisch abgeschiedenes Silber reflektiert über 99,5 % des sichtbaren Lichtes. Als „weißestes“ aller Gebrauchsmetalle wird es daher auch zur Herstellung von Spiegeln[22] benutzt. Strichfarbe ist ein gräuliches Weiß. Mit abnehmender Korngröße wird die Farbe immer dunkler und ist bei fotografisch fein verteilten Silberkristallen schwarz. Das Reflexionsspektrum zeigt im nahen UV eine ausgeprägte Plasmakante.
Silber leitet von allen Metallen Wärme und Elektrizität am besten. Wegen seiner Dehnbarkeit und Weichheit (Mohshärte von 2,5–4) lässt es sich zu feinsten, blaugrün durchschimmernden Folien von einer Dicke von nur 0,002 bis 0,003 mm aushämmern oder zu dünnen, bei 2 km Länge nur 0,1 bis 1 g wiegenden Drähten (Filigrandraht) ausziehen.
Im geschmolzenen Zustand löst reines Silber leicht aus der Luft das 20-fache Volumen an Sauerstoff, der beim Erstarren der Schmelze unter Aufplatzen der bereits erstarrten Oberfläche (Spratzen) wieder entweicht. Bereits gering legiertes Silber zeigt diese Eigenschaft nicht.
Chemische Eigenschaften

Silber ist ein Edelmetall mit einem Normalpotential von +0,7991 V. Aus diesem Grund ist es relativ reaktionsträge. Es reagiert auch bei höherer Temperatur nicht mit dem Sauerstoff der Luft. Da in der Luft spurenweise Schwefelwasserstoff H2S enthalten ist, laufen Silberoberflächen allerdings mit der Zeit schwarz an, da elementares Silber mit Schwefelwasserstoff in Anwesenheit von Luftsauerstoff Silbersulfid (Ag2S) bildet:
- .
Silber löst sich nur in oxidierenden Säuren, wie beispielsweise Salpetersäure. In nichtoxidierenden Säuren ist es nicht löslich. Auch in Cyanid-Lösungen löst es sich bei Anwesenheit von Sauerstoff durch die Bildung eines sehr stabilen Silbercyanid-Komplexes, wodurch das elektrochemische Potential stark verschoben ist. In konzentrierter Schwefel- und Salpetersäure löst sich Silber nur bei erhöhten Temperaturen, da es durch Silbernitrat und -sulfat passiviert ist. Silber ist stabil gegen geschmolzene Alkalihydroxide wie Natriumhydroxid. Im Labor verwendet man darum für diese Schmelzen auch Silber- anstatt Porzellan- oder Platintiegel.
Biologisch-medizinische Eigenschaften
Silber wirkt in feinstverteilter Form bakterizid, also schwach toxisch, was aufgrund der großen reaktiven Oberfläche auf die hinreichende Entstehung von löslichen Silberionen zurückzuführen ist. Im lebenden Organismus werden Silberionen jedoch in der Regel schnell an Schwefel gebunden und scheiden aus dem Stoffkreislauf als dunkles, schwer lösliches Silbersulfid aus. Die Wirkung ist oberflächenabhängig. Dies wird in der Medizin genutzt für Wundauflagen wie für invasive Geräte (z. B. endotracheale Tuben).[23] In der Regel wird Silber für bakterizide Zwecke daher in Medizinprodukten als Beschichtung oder in kolloidaler Form eingesetzt, zunehmend auch Nanosilber. Silberionen finden als Desinfektionsmittel und als Therapeutikum in der Wundtherapie Verwendung. Sie können silberempfindliche Erreger nach relativ langer Einwirkzeit reversibel inhibieren, können darüber hinaus bakteriostatisch oder sogar bakterizid (also abtötend) wirken. Man spricht hier vom oligodynamischen Effekt. In manchen Fällen werden Chlorverbindungen zugesetzt, um die geringe Wirksamkeit des Silbers zu erhöhen.
Dabei kommen verschiedene Wirkmechanismen zum Einsatz:[24]
- Blockierung von Enzymen und Unterbindung deren lebensnotwendiger Transportfunktionen in der Zelle,
- Beeinträchtigung der Zellstrukturfestigkeit,
- Schädigung der Membranstruktur.
Die beschriebenen Effekte können zum Zelltod führen.
Neben der Argyrie, einer irreversiblen schiefergrauen Verfärbung von Haut und Schleimhäuten, kann es bei erhöhter Silberakkumulation im Körper außerdem zu Geschmacksstörungen und Riechstörungen sowie zerebralen Krampfanfällen kommen. Silber reichert sich in der Haut, der Leber, den Nieren, der Hornhaut der Augen, im Zahnfleisch, in Schleimhäuten, Nägeln und der Milz an.[25]
Umstritten ist die therapeutische Einnahme von kolloidalem Silber, das seit einigen Jahren wieder verstärkt ins Blickfeld der Öffentlichkeit rückt und über Internet und andere Kanäle vermarktet wird. Es wird vor allem als Universalantibiotikum angepriesen und soll noch andere Leiden kurieren können. Wissenschaftliche Studien über die Wirksamkeit gibt es nicht. Bereits die mit einem gängigen Antibiotikum vergleichbare Wirkung ist bei peroraler Verabreichung stark anzuzweifeln. Sehr geringe oral aufgenommene Mengen bis 5 Mikrogramm Silber pro Kilogramm Körpergewicht und Tag sollen nach Ansicht der amerikanischen Umweltschutzbehörde EPA zu keiner Vergiftung führen.[26]
Silber wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Silber waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung. Die Neubewertung fand ab 2014 statt und wurde von den Niederlanden durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[27][28]
Mythologische Eigenschaften
Silber gilt in vielen Märchen und Sagen als das einzige Metall, das in der Lage ist, Werwölfe und andere mythologische Wesen zu töten, was auch in modernen Fantasy-Romanen und Filmen häufig aufgegriffen wird.[29]
Verwendung
Silberpreis
Der Preis des Silbers wird auf dem offenen Markt bestimmt. Das geschieht seit dem 17. Jahrhundert am London Bullion Market. Die Einführung des Silberfixings 1897 in London markiert den Beginn der Marktstruktur. 1987 wurde die London Bullion Market Association (LBMA) gegründet. Drei LBMA-Mitglieder nehmen am Silberfixing an jedem Arbeitstag unter Vorsitz der Bank of Nova Scotia - ScotiaMocatta teil. Weitere Mitglieder des Silberfixings sind die Deutsche Bank AG London und HSBC Bank USA NA London Branch.
In den 1970er Jahren führte die Silberspekulation der Brüder Hunt zu einem Rekordstand beim Silberpreis. Diese kauften im Zusammenspiel mit vermögenden Geschäftsleuten aus Saudi-Arabien riesige Mengen an Silber sowie Silberkontrakten an den Warenterminbörsen und versuchten, den Silbermarkt zu beherrschen.[30] Am 18. Januar 1980 wurde beim Silberfixing am London Bullion Market ein Rekordstand von 49,45 US-Dollar pro Feinunze ermittelt. Den nächsten Rekord erreichte der Silberpreis erst über 31 Jahre später, am 25. April 2011, als die Feinunze Silber in Hong Kong mit 49,80 US-Dollar gehandelt wurde.[31] Dem Inflationsrechner des United States Department of Labor zufolge entsprechen 49,45 US-Dollar von 1980 im Jahr 2011 einer Summe von 134,99 US-Dollar.[32] Daher dürfte es noch lange dauern bis der Preis von 1980 unter Berücksichtigung der Inflation überschritten wird.
Für den standardisierten Silberhandel an Rohstoffbörsen wurde „XAG“ als eigenes Währungskürzel nach ISO 4217 vergeben. Es bezeichnet den Preis einer Feinunze Silber (31,1 Gramm).
Währung und Wertanlage
Die früher wichtigste Verwendung war die Herstellung von Silbermünzen als Zahlungsmittel. Für Münzen wurde in der Antike und im Mittelalter nur Silber, Gold und Kupfer bzw. Bronze verwendet. Der Münzwert entsprach weitgehend dem Metallwert (Kurantmünze). In Deutschland waren bis 1871 Silbermünzen (Taler) vorherrschend, die Währung war durch Silber gedeckt (Silberstandard). Nach 1871 wurde der Silber- durch den Goldstandard abgelöst. Der Grund für die Verwendung dieser Edelmetalle waren die hohe Wertspeicherung (Seltenheit) und Wertbeständigkeit von Silber und Gold. Erst in moderner Zeit werden Münzen auch aus anderen Metallen, wie Eisen, Nickel oder Zink hergestellt, deren Metallwert aber geringer ist und nicht dem aufgeprägten Wert entspricht (Scheidemünze). Silber wird als Münzmetall heute meist nur noch für Anlage-, Gedenk- und Sondermünzen verwendet.
Besonders in Zeiten von Wirtschaftskrisen – wie z. B. ab 2007 – hat sich neben Gold auch das Edelmetall Silber durch seine Kurs- und Wertstabilität als eine der wichtigsten Anlageform in verschiedensten Ausprägungen wie z. B. Silberbarren, Silberschmuck oder Silbermünzen erwiesen.[33] Im Umfeld von Währungskrisen gab es seit der Antike mehrmals in der Geschichte ein Silberverbot (s. Goldverbot).
Wirtschaft und Sport
Silber ist neben Gold und Edelsteinen (z. B. Diamanten) ein wichtiges Material für die Herstellung von Schmuck und wird seit Jahrhunderten für erlesenes und wertbeständiges Essbesteck (Tafelsilber) und Sakrales Gerät verwendet. Silberstempel (Meistermarke, Stadtmarke, Steuermarke u. a. Punzen) geben Auskunft über die Herkunft des Gegenstandes. Bei Schmuck, Gerät und Barren kann der Silbergehalt, sofern angegeben, anhand des Feingehaltstempels abgelesen werden.
Silbermedaillen werden bei vielen Sportwettkämpfen, z. B. bei den Olympischen Spielen, als Zeichen für das Erreichen des zweiten Platzes verliehen. Die olympische Goldmedaille besteht ebenfalls zu 92,5 % aus Silber und ist lediglich mit 6 g reinem Gold vergoldet. Auch in anderen Bereichen werden Auszeichnungen häufig als „silbern“ bezeichnet. Beispiele sind Silberner Bär, Silberner Griffel, Silberner Schuh und Silbernes Lorbeerblatt.
Sehr begehrt ist es auch bei Musikinstrumenten, da es aufgrund seiner Dichte einen schönen, warmen Ton von sich gibt, leicht zu verarbeiten ist und z. B. bei der Querflöte das empfindliche Holz ersetzt.
Silber besitzt die höchste elektrische Leitfähigkeit aller Metalle, eine hohe Wärmeleitfähigkeit und eine ausgeprägte optische Reflexionsfähigkeit. Dadurch ist es für Anwendungen in Elektrik, Elektronik und Optik prädestiniert. Die Reflexionsfähigkeit von Glasspiegeln beruht auf der chemischen Versilberung von Glasscheiben. Dieses Prinzip wird auch bei der Fertigung von Christbaumschmuck, Optiken und Licht- oder Wärmereflektoren verwendet. Eine Suspension von Silberpulver in Klebstoffen macht sie zu elektrisch (und thermisch) leitfähigen Klebern.
Die Schwärzung der Silberhalogenide infolge ihres Zerfalls durch Licht und Entwicklung wird beim Fotopapier genutzt. Es bildete von etwa 1850 bis zur Verbreitung der Digitaltechnik die Grundlage der Fotografie.
Silberlegierungen (mit Kupfer, Zink, Zinn, Nickel, Indium usw.) werden in der Elektrotechnik und Löttechnik als Lotlegierungen (sogenanntes Hartlöten), Kontaktmaterialien (z. B. in Relais) und Leitmaterial (z. B. als Kondensatorbeläge) verwendet. Silberlegierungen werden aber auch in der Dentaltechnik und im dekorativen Bereich verwendet.
Silbergeschirre und -geräte geben beim Gebrauch immer etwas Silber an die Speisen und Getränke ab, was sich besonders bei manchen Getränken (Wein) in einem unangenehmen Metallgeschmack bemerkbar machen kann. Um dies zu vermeiden, werden silberne Trinkgefäße oft innen vergoldet. Durch Silbersulfid angelaufenes Silber wird entweder poliert oder chemisch reduziert (siehe Silberpflege).
Silber in medizinischen und medizinnahen Anwendungen
Werkstoffe oder Beschichtungsverfahren nutzen die antibakterielle Wirkung von Silber in Medizinprodukten und anderen Anwendungen in Form von Silberbeschichtungen, als kolloidales Silber, Nanosilber oder in Form von Silberfäden. Beispiele in Medizinprodukten:
- Wundauflagen mit kolloidalem Silber oder Nanosilber
- Silberbeschichtungen endoskopischer Tuben
- Silberbeschichtung von Endoprothesen
- Kunststoffe mit Silberdotierung zur Anwendung in der Medizintechnik
- Silberhaltige Cremes als Arzneimittel und Kosmetika, z. B. bei Schuppen mit Hautpilzverdacht oder bei Neurodermitis
- Silberplatte als Knochenersatz, typischerweise Schädelknochen, etwa bei Lex Barker nach schwerer Kopfverletzung 1944.[34] In Münchhausens Reise nach Rußland und St. Petersburg (ab 1739) wird 1786 über einen trinkfesten General fabuliert, der "zugleich mit seinem Hute eine an demselben befestigte silberne Platte aufhob, die ihm statt des Hirnschädels diente."
Beispiele für Hygiene- und andere Anwendungen
- Silberfäden oder Silberionen hemmen in der antimikrobiellen Ausrüstung von Textilien das Wachstum von Bakterien auf der Haut und verhindern damit unangenehme Gerüche.
- Beschichtung von Oberflächen, z. B. in Kühlschränken, auf Küchenmöbeln, Lichtschaltern und anderen Gegenständen
- Antibakterielle Emaillierungen und Keramiken
- Silberbeschichtete Wasserfilterkartuschen
- Beläge von keramischen Kondensatoren für die Elektrotechnik/Elektronik
In Bezug auf die nichtmedizinische Anwendung von Silber empfiehlt das Bundesinstitut für Risikobewertung (BfR) vorerst generell auf den Einsatz von nanoskaligem Silber oder nanoskaligen Silberverbindungen in verbrauchernahen Produkten zu verzichten.[35]
Silber in der Katalyse
Silberkatalysatoren finden industrielle Anwendung in der Partialoxidation von Ethen zu Ethylenoxid bzw. von Methanol zu Formaldehyd.[36][37] Durch die Bedeutung des Silbers für die Oxidationskatalyse sind zahlreiche Untersuchungen zur Wechselwirkung von Silberoberflächen mit Sauerstoff durchgeführt worden. Verschiedene Sauerstoffspezies sind an der Silberoberfläche, im oberflächennahen Bereich und im Silbervolumen lokalisiert. Neben Spezies, die auf das Substrat übertragen werden und mehr oder weniger selektiv zur Oxidation eines Moleküls führen, sind auch Zentren vorhanden, die eine katalytische Dehydrierung ermöglichen. Dies ist interessant im Zusammenhang mit der Tatsache, dass die Partialoxidation von Methanol zu Formaldehyd unterstöchiometrische Mengen an Sauerstoff erfordert.[38] Die Bildung der Sauerstoffspezies ist abhängig von der Temperatur, aber auch von der Art der Reaktionsatmosphäre. Bestimmte O-Spezies sind ex situ nicht nachweisbar und stellen hohe Anforderungen an die eingesetzten Charakterisierungsmethoden.[39][40]
Silber katalysiert anderseits auch die Reduktion organischer Substrate durch Wasserstoff, z. B. die Hydrierung von α,β-ungesättigten Carbonylverbindungen. Die Wechselwirkung von H2 mit Silberkatalysatoren ist – verglichen mit klassischen Hydrierkatalysatoren wie Platin – nur schwach ausgeprägt.[41] Ag-Katalysatoren sind deshalb in der Lage, Doppelbindungen von bi-/multifunktionellen Molekülen selektiv zu hydrieren (z. B. Hydrierung von Acrolein zu Allylalkohol).
Nichtmetallische und nicht bakterizide Silberanwendungen
Silber wird als Lebensmittelfarbstoff E 174 auch im Speisenbereich verwendet, zum Beispiel für Überzüge von Süßwaren wie etwa Pralinen und in Likören. Silbersalze färben Glas und Emaille gelb.
Silberlegierungen
Silber ist mit vielen Metallen legierbar. Gut legieren lässt es sich mit Gold, mit Kupfer oder mit Palladium (ein Palladiumgehalt von 20 bis 30 Prozent macht das Silber anlaufbeständig). In begrenztem Maße lässt sich Silber mit Chrom, Mangan oder Nickel legieren. Legieren erhöht zumeist die Härte des Silbers. Mit Cobalt oder Eisen lässt es sich nicht legieren.
Die wichtigsten Silberlegierungen sind heute Kupfer-Silber-Legierungen. Sie werden meist nach ihrem Feingehalt an Silber, angegeben in Tausendstel, bezeichnet. Die gebräuchlichsten Silberlegierungen haben einen Feingehalt von 800, 835, 925 und 935 Tausendstel Teile Silber. 925er Silber wird nach der britischen Währung Pfund Sterling als Sterlingsilber bezeichnet. Es gilt als die wichtigste Silberlegierung und wird u. a. zur Herstellung von Münzen, Schmuck und Besteck verwendet.
Im Hinblick auf den Export werden heute Korpuswaren vorwiegend aus einer Silberlegierung mit einem Feingehalt von 935/1000 hergestellt, da die Waren mit Silberloten gelötet werden, deren Feingehalt niedriger ist, um letztendlich dem gesetzlich geforderten Gesamtfeingehalt von beispielsweise 925/1000 zu genügen. Eine neuartige Legierung aus England ist Argentium™ Sterling Silber, das nicht anlaufen soll. Auch bei stark beanspruchten Bestecken geht seit Jahren der Trend zum Sterlingsilber. Silberwaren werden in der Regel abschließend feinversilbert, Bestecke und Verschleißartikel hartversilbert. Durch die reine Silberbeschichtung werden die verkaufsfördernde, strahlendweiße Silberfarbe und ein stark vermindertes Anlaufen der Waren erreicht.
Eine im Mittelalter für die Verzierung von Kunstwerken verwendete Silberlegierung ist das Tulasilber, eine Legierung von Silber, Kupfer, Blei und Schwefel. Silber wird häufig auch vergoldet; man nennt es mit einem aus dem Französischen beziehungsweise Lateinischen stammenden Wort dann „Vermeil“.
Verbindungen
Silber kommt in chemischen Verbindungen hauptsächlich in der Oxidationsstufe +I vor, die Oxidationsstufen +II, +III und +IV sind selten und meist nur in Komplexen stabil.
Oxide
- Silber(I)-oxid Ag2O ist ein dunkelbrauner Feststoff, der aus silberhaltigen Lösungen mit Basen, z. B. Natronlauge, ausfällt. Bei höheren Temperaturen zerfällt Ag2O in die Elemente.
Die Silberoxide mit Silber in Oxidationsstufen größer +I können nur auf elektrochemischem Wege dargestellt werden. Dies sind die Verbindungen Silber(I,III)-oxid AgO, Silber(II,III)-oxid Ag3O4 und Silber(III)-oxid Ag2O3.
Halogenide
Zu den wichtigsten Silberverbindungen zählen die Silberhalogenide. Sie zersetzen sich im Licht und werden deshalb in der Analogfotografie gebraucht. Silberhalogenide sind außer dem Fluorid schwer in Wasser löslich und dienen zum Nachweis von Halogenid-Ionen.
- Silber(I)-fluorid AgF ist farblos und als einziges Silberhalogenid gut wasserlöslich. Es ist im Gegensatz zu den anderen Silberhalogeniden nicht lichtempfindlich.
- Silber(I)-chlorid AgCl ist ein weißes, kristallines wasserunlösliches Pulver. Es dient als Nachweis für Chloridionen. Außerdem wird es in Referenzelektroden und in der Analogfotografie verwendet.
- Silber(I)-bromid ist hellgelb und ebenfalls wasserunlöslich. Da es lichtempfindlicher als Silberchlorid ist, dient es sehr häufig als lichtempfindliche Schicht in der Analogfotografie.
- Silber(I)-iodid ist wie Silberbromid gelb und wasserunlöslich. Es wird selten auch in der Analogfotografie verwendet. Manchmal wird Silberiodid von Flugzeugen als Kondensationskeim zur Regenbildung versprüht.
- Silber(II)-fluorid AgF2 ist eines der wenigen nicht komplexen zweiwertigen Silbersalze. Es wird als Fluorierungsmittel an Stelle von elementarem Fluor verwendet.
Weitere Verbindungen
- Silber(I)-sulfid Ag2S ist von allen Silbersalzen am schwersten wasserlöslich. Es ist schwarz und entsteht direkt aus den Elementen oder durch Versetzen silberhaltigen Lösungen mit Schwefelwasserstoff. Wenn Silberbesteck anläuft, besteht der dunkle Überzug ebenfalls aus Silbersulfid.
- Silbernitrat AgNO3 ist die wichtigste Silberverbindung und Ausgangsstoff für die Herstellung der meisten anderen Silberverbindungen. Es ist leicht wasserlöslich und wird durch Auflösen von Silber in Salpetersäure hergestellt.
- Silbersulfat Ag2SO4 entsteht beim Auflösen von Silber in konzentrierter Schwefelsäure.
- Silberazid AgN3 und Silberacetylid Ag2C2 sind hochexplosiv. Ersteres kann als Initialzünder von Sprengstoffen dienen. Das ebenfalls sehr explosive Silberfulminat AgCNO wird auch als Knallsilber bezeichnet.
- Silbercyanid AgCN ist ein hochgiftiges farbloses Pulver, das beim Versetzen von Silbersalzlösungen mit Cyanidionen ausfällt.
Silber in höheren Oxidationsstufen tritt beispielsweise im Tetrapyridinosilber(II)-persulfat – [Ag(C5H5N)4]S2O8, im Kaliumtetrafluoroargentat(III) K[AgF4] oder Caesiumhexafluoroargentat(IV) Cs2[AgF6] auf. Die giftigen Silbercyanide werden u. a. in galvanischen Bädern zur Versilberung und Farbvergoldung (hellgelb-grünlichgelb) eingesetzt. Bei Silber(I) ist die Neigung zur Bildung von Komplexionen ausgeprägt, meist mit der Koordinationszahl 2. Diese Komplexionen sind mit Ausnahme des erst in stark salzsaurer Lösung entstehenden [AgCl2]− nur in alkalischer oder neutraler Lösung beständig.
Nachweis
Beim Zutropfen von Halogenid-Lösung in die zu prüfende Flüssigkeit bilden sich beim Vorhandensein von Silber-Kationen Niederschläge, z. B.:
- Ag+(aq) + Cl−(aq) → AgCl (s)
Als Nachweisreaktion für Silbersalze erfolgt daher die Zugabe von Salzsäure oder Natriumchloridlösung. Es bildet sich ein weißer Niederschlag von Silberchlorid, der löslich in verdünntem Ammoniakwasser ist, wobei der Silberdiamminkomplex [Ag(NH3)2]+ entsteht. Bei hohen Konzentrationen an Chlorid löst sich das Silberchlorid teilweise wieder auf, da sich komplexe Dichloroargentate(I) bilden:
- AgCl + Cl− → [AgCl2]−
Der Niederschlag ist bei Iodid-Ionen (AgI) gelb-grünlich und in Ammoniakwasser unlöslich, bei Chlorid- und Bromid-Ionen (AgCl, AgBr) weißlich.
Heraldik
In der Heraldik wird Silber, wie auch Gold, als Metall bezeichnet, das zu den heraldischen Tinkturen zählt. Es wird häufig durch weiße Farbe wiedergegeben.
Siehe auch
- Kategorie:Silber - Artikel in der deutschen Wikipedia (Link zur Kategorie Silber auf Wikipedia)
- Silber - Artikel in der deutschen Wikipedia
- Silber/Tabellen und Grafiken - Artikel in der deutschen Wikipedia
- Silberelektrolyte - Artikel in der deutschen Wikipedia
- Galvanisierung - Artikel in der deutschen Wikipedia
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1452–1466.
- Günter Ludwig, Günter Wermusch: Silber. Aus der Geschichte eines Edelmetalls. Verlag Die Wirtschaft, Berlin 1986, ISBN 3-349-00101-7.
Weblinks
- Mineralienatlas – Silber (Bilder, Vorkommen, technische Fakten), Mineralienportrait Silber
Einzelnachweise
- ↑ Wärmeleitfähigkeit. auf der Webseite der Technischen Fakultät der Uni Kiel.
- ↑ 2,0 2,1 Vgl. Silber im Deutschen Wörterbuch der Brüder Grimm
- ↑ Vgl. Online Etymology Dictionary zu Englisch silver.
- ↑ Vgl. Online Etymology Dictionary zu Englisch argent (für Silber als heraldische Farbe).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1452–1466.
- ↑ IMA/CNMNC List of Mineral Names; July 2019 (PDF 1,67 MB; Silber siehe S. 178)
- ↑ IMA/CNMNC List of Mineral Names; 2009 (PDF 1,8 MB, Silber siehe S. 260).
- ↑ Webmineral – Minerals Arranged by the New Dana Classification. 01.01.01 Gold group.
- ↑ Mindat - Silver (englisch).
- ↑ Mineral Species containing Silver (Ag). auf: webmineral.com.
- ↑ Mindat - Kongsbergite.
- ↑ 12,0 12,1 Stefan Weiß: Das große Lapis Mineralienverzeichnis. Alle Mineralien von A – Z und ihre Eigenschaften. 6., vollkommen neu bearbeitete und ergänzte Auflage. Weise, München 2014, ISBN 978-3-921656-80-8.
- ↑ Mindat - Küstelite.
- ↑ Mineralienatlas: Anthropogene Silberlocken
- ↑ S. Jahn: Lockensilber aus Imiter - echt oder eine Fälschung? In: Min. Welt. Heft 6, 2008, S. 28–31.
- ↑ United States Geological Survey: Silver Statistics and Information
- ↑ 17,0 17,1 17,2 United States Geological Survey: World Mine Production and Reserves January 2019
- ↑ Trends der Angebots- und Nachfragesituation bei mineralischen Rohstoffen. (PDF; 2,1 MB), Rheinisch-Westfälisches Institut für Wirtschaftsforschung (RWI Essen), Fraunhofer-Institut für System- und Innovationsforschung (ISI), Bundesanstalt für Geowissenschaften und Rohstoffe (BGR).
- ↑ Jörg Mildenberger: Anton Trutmanns Arzneibuch Teil II: Wörterbuch, Band V. Würzburg 1997, ISBN 3-8260-1398-0, S. 2274.
- ↑ Geschichte des Kunststoffs - Alexander Parkes. auf: plasticker.de
- ↑ Anorganischer Experimentalvortrag: Silber S. 9, Elektrolytische Feinreinigung (Möbius-Verfahren). (MS Word; 1,1 MB).
- ↑ Ludwig Hartmann: Faraday an Liebig (1858): Zur Geschichte der Silberspiegelherstellung. In: Sudhoffs Archiv. 32, 1939/40, S. 397–398.
- ↑ {{Internetquelle |url=http://www.aerzteblatt.de/nachrichten/33419/Mit-Silber-beschichteter-Tubus-senkt-Pneumonierisiko |titel=Mit Silber beschichteter Tubus senkt Pneumonierisiko |werk=aerzteblatt.de |datum=2008-08-20 |zugriff=2014-12-26
- ↑ J. R. Morones-Ramirez, J. A. Winkler u. a.: Silver enhances antibiotic activity against gram-negative bacteria. In: Science Translational Medicine. Band 5, Nummer 190, Juni 2013, S. 190ra81, doi:10.1126/scitranslmed.3006276. PMID 23785037.
- ↑ M. Glehr, A. Leithner, J. Friesenbichler, W. Goessler, A. Avian, D. Andreou, W. Maurer-Ertl, R. Windhager, P.-U. Tunn: Argyria following the use of silver-coated megaprostheses. In: The Bone and Joint Journal. Band 95-B, Ausgabe 7, Juli 2013, S. 988–992.
- ↑ Silver (CASRN 7440-22-4). auf der Webseite der amerikanischen Umweltschutzbehörde EPA.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Vorlage:CoRAP-Status
- ↑ Robert Jackson: Witchcraft and the Occult. Quintet Publishing, Devizes 1995, S. 25.
- ↑ Steffen Uttich: Regeländerung mitten im Spiel. In: FAZ.net. 5. Juli 2008, abgerufen am 26. Dezember 2014.
- ↑ Übersicht der Tagesentwicklung zum Rekordkurs, April bis Mai 2011.
- ↑ Inflation Calculator.
- ↑ Michael Höfling: Silber-Rallye im Windschatten des Goldes. In: welt.de. 14. Oktober 2009, abgerufen am 26. Dezember 2014.
- ↑ Inoffizielle Fanpage von Lex Barker – Biographie (abgerufen 31. Januar 2012).
- ↑ BfR rät von Nanosilber in Lebensmitteln und Produkten des täglichen Bedarfs ab, Stellungnahme von 2009 (pdf-Datei, 84 kB), abgerufen am 14. Februar 2012.
- ↑ P. A. Kilty, W. M. H. Sachtler: The Mechanism of the Selective Oxidation of Ethylene to Ethylene Oxide. In: Catalysis Reviews. 10, 1974, S. 1–16; doi:10.1080/01614947408079624
- ↑ H. Sperber: Herstellung von Formaldehyd aus Methanol in der BASF. In: Chemie Ingenieur Technik. 41, 1969, S. 962–966; doi:10.1002/cite.330411705.
- ↑ A. Nagy, G. Mestl, T. Rühle, G. Weinberg, R. Schlögl: The Dynamic Restructuring of Electrolytic Silver during the Formaldehyde Synthesis Reaction. In: Journal of Catalysis. 179, 1998, S. 548–559; doi:10.1006/jcat.1998.2240.
- ↑ V. I. Bukhtiyarov, A. I. Nizovskii, H. Bluhm, M. Hävecker, E. Kleimenov, A. Knop Gericke, R. Schlögl: Combined in situ XPS and PTRMS study of ethylene epoxidation over silver. In: Journal of Catalysis. 238, 2006, S. 260–269; doi:10.1016/j.jcat.2005.11.043.
- ↑ A. Knop-Gericke, E. Kleimenov, M. Hävecker, R. Blume, D. Teschner, S. Zafeiratos, R. Schlögl, V. I. Bukhtiyarov, V. V. Kaichev, I. P. Prosvirin, A. I. Nizovskii, H. Bluhm, A. Barinov, P. Dudin, M. Kiskinova: Chapter 4 X-Ray Photoelectron Spectroscopy for Investigation of Heterogeneous Catalytic Processes. In: Advances in Catalysis. 52, 2009, S. 213–272; doi:10.1016/S0360-0564(08)00004-7.
- ↑ J. Hohmeyer: Charakterisierung von Silberkatalysatoren für die Selektivhydrierung mittels DRIFT-Spektroskopie, Adsorptionskalorimetrie und TAP-Reaktor. Dissertation. Fritz-Haber-Institut Berlin / Technische Universität Darmstadt, 2009.




![{\displaystyle \mathrm {2\ Ag+H_{2}O+\ ^{1}/_{2}\ O_{2}+4\ NaCN\rightarrow \ 2\ Na[Ag(CN)_{2}]\ +\ 2\ NaOH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fba93cd5116a374b26aa38f72742866453ea44dc)
![{\displaystyle \mathrm {Ag_{2}S\ +4\ NaCN\rightarrow \ 2\ Na[Ag(CN)_{2}]\ +\ Na_{2}S} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6bf0f1c4f727b94f22faf612ed38e2cb4885b6f)
![{\displaystyle \mathrm {AgCl\ +2\ NaCN\rightarrow \ Na[Ag(CN)_{2}]\ +\ NaCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a590c9281279d9c39aa718d4ce1a2e9eef95360)
![{\displaystyle \mathrm {2\ Na[Ag(CN)_{2}]\ +Zn\rightarrow \ Na_{2}[Zn(CN)_{4}]+\ 2\ Ag} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd1b344603946cf96dec47c9df68b469b2610fa0)